福建省名校联盟2020-2021学年高三下学期化学开学考试试卷(新高考)
试卷更新日期:2021-03-30 类型:开学考试
一、单选题
-
1. 春季复工、复学后,公用餐具消毒是防控新型冠状病毒传播的有效措施之一。下列可直接用作公用餐具消毒剂的是( )A、95%的乙醇溶液 B、40%的甲醛溶液 C、次氯酸钠稀溶液 D、生理盐水2. 设阿伏加德罗常数的值为NA。下列说法正确的是( )A、5.6g乙烯和环丙烷的混合物中含C—H键数目为0.8NA B、常温下,将2.8g铁块投入足量浓硝酸中,转移0.15NA电子 C、标准状况下,22.4LCl2溶于水,转移的电子数为NA D、25℃时,pH=4的CH3COOH溶液中H+的数目为10-4NA3. 磷酸氯喹可在细胞水平上有效抑制2019- 病毒。氯喹是由喹啉通过一系列反应制得的,氯喹和喹啉的结构简式如图。下列关于氯喹和喹啉的说法正确的是( )
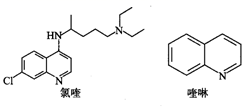 A、氯喹的分子式为 B、氯喹分子中三个氮原子可处在同一个平面 C、氯喹可以发生加成反应和中和反应 D、喹啉的一氯代物有5种4. 下列实验装置及相应操作正确的是( )
A、氯喹的分子式为 B、氯喹分子中三个氮原子可处在同一个平面 C、氯喹可以发生加成反应和中和反应 D、喹啉的一氯代物有5种4. 下列实验装置及相应操作正确的是( )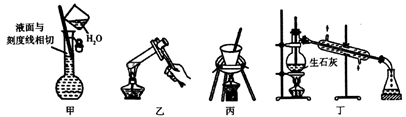 A、图甲可用于配制250mL 0.100mol/L硫酸溶液时定容操作 B、图乙可用于淀粉在稀硫酸作用下发生水解后,直接滴加新制氢氧化铜悬浊液检验水解产物 C、图丙可用于胆矾结晶水含量测定 D、图丁可用于由工业乙醇制备无水乙醇5. 某种固体消毒剂广泛用于游泳池消毒,其结构如图所示,其中W、X、Y、Z是原子序数依次增大的四种短周期元素,Y的最外层电子数是内层电子数的3倍。下列叙述错误的是( )
A、图甲可用于配制250mL 0.100mol/L硫酸溶液时定容操作 B、图乙可用于淀粉在稀硫酸作用下发生水解后,直接滴加新制氢氧化铜悬浊液检验水解产物 C、图丙可用于胆矾结晶水含量测定 D、图丁可用于由工业乙醇制备无水乙醇5. 某种固体消毒剂广泛用于游泳池消毒,其结构如图所示,其中W、X、Y、Z是原子序数依次增大的四种短周期元素,Y的最外层电子数是内层电子数的3倍。下列叙述错误的是( )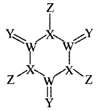 A、W和Z组成的化合物可以做灭火剂 B、原子半径:W>X>Y C、氧化物对应的水化物的酸性:X>W D、该化合物中X、Y、Z均满足8电子稳定结构6. 下列指定反应的离子方程式正确的是( )A、 溶液与稀硫酸的反应: B、向 溶液中加入少量 溶液: C、向 溶液中通入 气体: D、碳酸氢钠溶液和过量的澄清石灰水混合:7. 电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图甲为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图乙为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线。下列判断错误的是( )
A、W和Z组成的化合物可以做灭火剂 B、原子半径:W>X>Y C、氧化物对应的水化物的酸性:X>W D、该化合物中X、Y、Z均满足8电子稳定结构6. 下列指定反应的离子方程式正确的是( )A、 溶液与稀硫酸的反应: B、向 溶液中加入少量 溶液: C、向 溶液中通入 气体: D、碳酸氢钠溶液和过量的澄清石灰水混合:7. 电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图甲为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图乙为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线。下列判断错误的是( )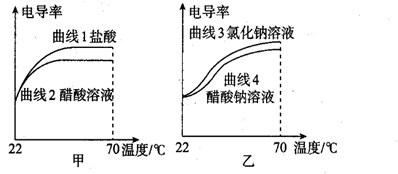 A、由曲线2可推测:温度升高可以提高离子迁移速率 B、由曲线4可推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关 C、由图甲、乙可判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是 的迁移速率大于 的迁移速率 D、由图甲、乙可判定:两图中电导率的差值不同,与溶液中 的浓度和迁移速率有关8. 采用(NH4)2SO4和 混合溶液作为电解液,平行放置的两块不锈钢板分别作为阴极和阳极,将废铅膏(主要成分为PbO2)平铺在阴极板上,可得到铅单质。这是一种成本较低的铅回收工艺,示意图如图下列说法错误的是( )
A、由曲线2可推测:温度升高可以提高离子迁移速率 B、由曲线4可推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关 C、由图甲、乙可判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是 的迁移速率大于 的迁移速率 D、由图甲、乙可判定:两图中电导率的差值不同,与溶液中 的浓度和迁移速率有关8. 采用(NH4)2SO4和 混合溶液作为电解液,平行放置的两块不锈钢板分别作为阴极和阳极,将废铅膏(主要成分为PbO2)平铺在阴极板上,可得到铅单质。这是一种成本较低的铅回收工艺,示意图如图下列说法错误的是( )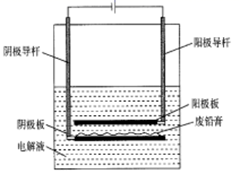 A、阴极板的电极反应为 B、电子由阳极板沿阳极导杆移向外接电源正极 C、电解过程中,OH-向阴极板迁移 D、标准状况下,外电路中每转移4mol电子,阳极板产生22.4LO29. 工业上利用 对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为 和NO在催化剂( )表面转化为 和 ,反应进程中的相对能量变化如图所示。下列说法错误的是( )
A、阴极板的电极反应为 B、电子由阳极板沿阳极导杆移向外接电源正极 C、电解过程中,OH-向阴极板迁移 D、标准状况下,外电路中每转移4mol电子,阳极板产生22.4LO29. 工业上利用 对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为 和NO在催化剂( )表面转化为 和 ,反应进程中的相对能量变化如图所示。下列说法错误的是( )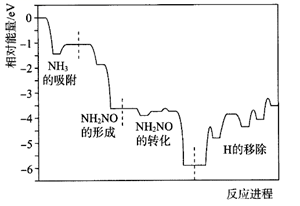 A、总反应方程式为 B、 是脱硝反应的活性中间体 C、升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度 D、决定反应速率的步骤是“H的移除”10. 室温时,向 20 mL 0.1 mol·L− 1 的两种酸 HA、HB 中分别滴加0.1 mol·L− 1 NaOH 溶液, 其 pH 变化分别对应下图中的 I、II。下列说法错误的是( )
A、总反应方程式为 B、 是脱硝反应的活性中间体 C、升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度 D、决定反应速率的步骤是“H的移除”10. 室温时,向 20 mL 0.1 mol·L− 1 的两种酸 HA、HB 中分别滴加0.1 mol·L− 1 NaOH 溶液, 其 pH 变化分别对应下图中的 I、II。下列说法错误的是( ) A、向 NaA 溶液中滴加 HB 可产生 HA B、滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)=c(B-) C、a 点,溶液中微粒浓度:c(A-) > c(Na+) D、滴加 20 mL NaOH 溶液时,I 中 H2O 的电离程度大于 II 中
A、向 NaA 溶液中滴加 HB 可产生 HA B、滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)=c(B-) C、a 点,溶液中微粒浓度:c(A-) > c(Na+) D、滴加 20 mL NaOH 溶液时,I 中 H2O 的电离程度大于 II 中二、综合题
-
11. 氨基甲酸铵 是一种易分解、易水解的白色固体,易溶于水,难溶于 ,某研究小组用如图所示的实验装置制备氨基甲酸铵。
反应原理:
实验室可选用下列装置制备氨基甲酸铵 。
回答下列问题:
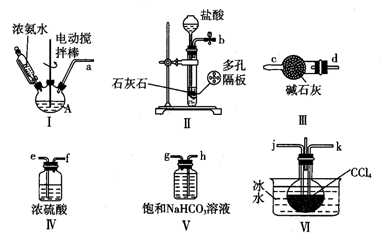 (1)、仪器A的名称是 , 其中加入的固体可(填名称);按气流方向连接各仪器:a→→j k←←b(用接口字母表示连接顺序)。(2)、装置Ⅱ的优点是。(3)、装置Ⅵ中,采用冰水浴的原因为;当 液体中产生较多晶体悬浮物时即停止反应,(填操作名称)得到粗产品。为了将所得粗产品干燥,可采取的方法是(填标号)
(1)、仪器A的名称是 , 其中加入的固体可(填名称);按气流方向连接各仪器:a→→j k←←b(用接口字母表示连接顺序)。(2)、装置Ⅱ的优点是。(3)、装置Ⅵ中,采用冰水浴的原因为;当 液体中产生较多晶体悬浮物时即停止反应,(填操作名称)得到粗产品。为了将所得粗产品干燥,可采取的方法是(填标号)A.蒸馏 B.高压加热烘干 C.真空微热烘干
(4)、某同学认为这套装置制得的氨基甲酸铵易变质,同时不符合绿色化学理念,改进了装置,具体做法是 , 其作用为。12. 镉(Cd)可用于制作某些发光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如下: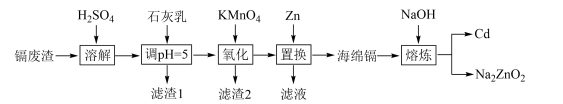
回答下列问题:
(1)、“滤渣1”的主要成分为 Cu(OH)2和(填化学式)。(2)、“氧化”时KMnO4的还原产物是MnO2 , 该步骤中除铁、除锰的离子方程式分别为、。(3)、“置换”中镉置换率与( )的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。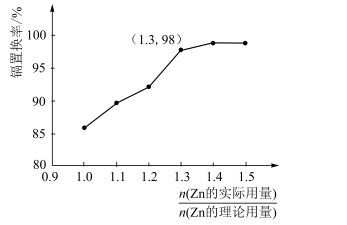
①实际生产中 比值最佳为1.3,不宜超过该比值的原因是。
②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为kg。
(4)、“置换”后滤液溶质主要成分是(填化学式)。(5)、“熔炼”时,将海绵镉(含Cd和Zn)与NaOH混合反应,反应的化学方程式是。当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的不同,将Cd从反应釜下口放出,以达到分离的目的。13. 羰基硫(COS)广泛存在于煤、石油和天然气为原料的化工生产中,不经处理直接排放会引起大气污染,石油化工中产生的羰基硫可通过以下方法脱除。(1)、Ⅰ.干法脱除:在催化剂存在下,COS和H2可发生两个平行反应:i. COS(g)+H2(g) H2S(g)+CO(g)△H1=-17kJ/mol
ii. COS(g)+4H2(g) H2S(g)+CH4(g)+H2O(g) △H2
已知:CH4(g)+H2O(g) CO(g)+3H2(g)△H=+206kJ/mol,则△H2=。
(2)、T1℃时,向10L恒容密闭容器中充人1molCOS和4molH2 , 发生反应i和ii。5min时达到平衡,测得体系压强减少了20%,CO的体积分数为10%且其平衡分压为P1。①0-5min内,v(COS)=。
②反应i的平衡常数K=。
③若在起始温度为T1℃的绝热容器中重复上述实验,H2的平衡分压P2P1(填“>”“=”或“<”),理由为。
(3)、Ⅱ.湿法脱除:原理为COS+4OH-=S2-+CO32-+2H2O。温度为293K时,将COS以固定流速匀速通入一定浓度的NaOH溶液中,测得体系内c(S2-)随时间(t)的变化如图所示:
由图可知,增大NaOH溶液的初始浓度,COS的吸收速率(填“增大”“减小”或“不变”),判断依据为。
(4)、在上述反应体系中同时加入少量溴水,也能吸收COS并得到澄清溶液,发生反应的化学方程式为。三、结构与性质
-
14. 镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:(1)、硒常用作光敏材料,基态硒原子的核外电子排布式为;与硒同周期的p区元素中第一电离能大于硒的元素有种; 的空间构型是。(2)、根据元素周期律,原子半径Ga As(填“大于”或“小于”,后同),第一电离能Ga As。(3)、GaN、GaP、GaAs都是很好的半导体材料,熔点如表所示,分析其变化原因:。
GaN
GaP
GaAs
熔点
1700℃
1480℃
1238℃
(4)、GaN晶胞结构如图甲所示。已知六棱柱底边边长为 ,阿伏加德罗常数的值为 。
①晶胞中镓原子采用六方最密堆积,每个镓原子周围距离最近的镓原子数目为。
②从GaN晶体中“分割”出的平行六面体如图乙。若该平行六面体的高为 ,GaN晶体的密度为 (用 表示)。
15. G是具有抗菌作用的白头翁素衍生物,其合成路线如下: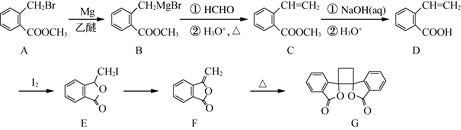 (1)、C中官能团的名称为和。(2)、E→F的反应类型为。(3)、D→E的反应有副产物X(分子式为C9H7O2I)生成,写出X的结构简式:。(4)、F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、C中官能团的名称为和。(2)、E→F的反应类型为。(3)、D→E的反应有副产物X(分子式为C9H7O2I)生成,写出X的结构简式:。(4)、F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①能发生银镜反应;
②碱性水解后酸化,其中一种产物能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(5)、请写出以乙醇为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。