山东省淄博七中2016-2017学年高一上学期化学期中考试试卷
试卷更新日期:2017-10-27 类型:期中考试
一、选择题
-
1. 在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的( )A、
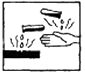 B、
B、 C、
C、 D、
D、 2. 下列分类不正确的是( )A、纯碱、烧碱均属于碱类 B、CO2、SiO2、SO2均属于酸性氧化物 C、醋酸、硫酸、硝酸均属于酸类 D、Na2CO3、Na2SO3、NaCl均属于钠盐3. 下列说法正确的是( )A、1mol西瓜 B、摩尔是7个基本物理量之一 C、常温常压下,22.4L氧气的物质的量为1mol D、Na的摩尔质量为23g•mol﹣14. 下列说法正确的是( )A、22.4L氧气中一定含有6.02×1023个氧分子 B、18g水在标准状况下的体积是22.4L C、标准状况下,20mL NH3与60mL O2所含的分子数之比为1:3 D、物质的摩尔质量在数值上等于其相对分子质量或相对分子质量5. 下列各组混合物中,能用分液漏斗进行分离的是( )A、酒精和水 B、碘和四氯化碳 C、水和四氯化碳 D、汽油和植物油6. 在物质分类中,前者包括后者的是( )A、氧化物、化合物 B、化合物、非电解质 C、溶液、胶体 D、溶液、分散系7. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、蔗糖溶液 B、盐酸 C、氯化钠溶液 D、Fe(OH)3胶体8. 下列物质中,属于电解质的是( )A、CO2 B、H2 C、Na2SO4 D、Cu9. 下列化学方程式中,不能用H++OH﹣=H2O表示的是( )A、2NaOH+H2SO4═Na2SO4+2H2O B、Ba(OH)2+2HCl═BaCl2+2H2O C、KOH+HCl═KCl+H2O D、Cu(OH)2+2HNO3═Cu(NO3)2+2H2O10. 关于氧化还原反应,下列说法不正确的是( )A、氧化反应和还原反应一定同时发生 B、一定有单质参加反应 C、反应前后一定有元素的化合价发生变化 D、氧化剂一定是反应过程中得到电子的物质11. 下列各组离子,在溶液中可以大量共存且为无色的是( )A、Ag+、Cu2+、Cl﹣、NO3﹣ B、Fe2+、NH4+、CO32﹣、OH﹣ C、Na+、Cl﹣、K+、OH﹣ D、H+、K+、Fe3+、NO3﹣12. 下列各溶液中,Na+物质的量浓度最大的是( )A、2L 0.5mol/L NaCl溶液 B、3L 0.3mol/L Na2SO4溶液 C、1L0.4mol/L Na2CO3溶液 D、4L 0.15mol/L Na3PO4溶液13. 下列离子方程式书写正确的是( )A、氢氧化钠溶液和稀盐酸反应:H++OH﹣═H2O B、大理石与盐酸反应制取二氧化碳:CO32﹣+2H+═H2O+CO2↑ C、铁粉投入盐酸溶液中:2Fe+6H+═Fe3++3H2↑ D、用小苏打治疗胃酸过多:CO32﹣+2H+═CO2↑+H2O14. 瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为( )A、1:4 B、1:2 C、1:1 D、2:115. 下列各组反应中,不能用同一个离子方程式表示的是( )A、盐酸分别与NaOH溶液、Ca(OH)2溶液反应 B、锌分别与稀盐酸、稀硫酸反应 C、硝酸分别与Na2CO3溶液、K2CO3溶液反应 D、硫酸分别与NaOH溶液、Ba(OH)2溶液反应16. 氢气还原氧化铜:CuO+H2 Cu+H2O,在该反应中( )A、Cu做还原剂 B、H2做氧化剂 C、铜元素的化合价降低 D、铜元素化合价升高17. 下列说法正确的是( )A、32gO2占有的体积约为22.4L B、a L甲烷和乙烷混合气体中的分子数约为 ×6.02×1023 C、在标准状况下,22.4L水的质量约为18g D、22g二氧化碳与标准状况下的11.2L HCl含有相同的分子数18. 分离四氯化碳和甲苯的混合物(两者互溶,沸点分别为76.75℃和110.6℃),可选用的分离方法为( )A、萃取法 B、蒸馏法 C、结晶法 D、分液法19. 将6.0mol•L﹣1 H2SO4溶液由10mL稀释至200mL,再从中取出20mL,这20mL溶液的物质的量浓度是( )A、0.05mol•L﹣1 B、0.30 mol•L﹣1 C、0.15 mol•L﹣1 D、0.5 mol•L﹣120. 下列变化需要加入还原剂才能实现的是( )A、Fe3+→Fe2+ B、HCl→Cl2 C、Fe→Fe2+ D、C→CO221. 下列电离方程式错误的是( )A、Ba(OH)2═Ba2++2OH﹣ B、NaHSO4═H++Na++SO42﹣ C、MgCl2═Mg2++2Cl﹣ D、NaHCO3═H++Na++CO32﹣22. 设NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、1molH2O所含有的原子数为NA B、32gO2含有的氧原子数为2NA C、常温常压下,11.2 LCl2 所含的分子数为0.5NA D、1L0.1mol/LNaCl溶液中所含的Na+数为NA23. 现有三组溶液,①碘水中提取单质碘 ②碘和四氯化碳的混合物 ③汽油和氯化钠溶液,分离以上混合物的正确方法依次是( )A、分液、萃取、蒸馏 B、萃取、蒸馏、分液 C、分液、蒸馏、萃取 D、蒸馏、萃取、分液24. 浊液区别于其他分散系最本质的特征是( )A、外观浑浊不清 B、浊液没有丁达尔现象 C、不稳定 D、分散质粒子直径大于100nm25. 过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤
2. 下列分类不正确的是( )A、纯碱、烧碱均属于碱类 B、CO2、SiO2、SO2均属于酸性氧化物 C、醋酸、硫酸、硝酸均属于酸类 D、Na2CO3、Na2SO3、NaCl均属于钠盐3. 下列说法正确的是( )A、1mol西瓜 B、摩尔是7个基本物理量之一 C、常温常压下,22.4L氧气的物质的量为1mol D、Na的摩尔质量为23g•mol﹣14. 下列说法正确的是( )A、22.4L氧气中一定含有6.02×1023个氧分子 B、18g水在标准状况下的体积是22.4L C、标准状况下,20mL NH3与60mL O2所含的分子数之比为1:3 D、物质的摩尔质量在数值上等于其相对分子质量或相对分子质量5. 下列各组混合物中,能用分液漏斗进行分离的是( )A、酒精和水 B、碘和四氯化碳 C、水和四氯化碳 D、汽油和植物油6. 在物质分类中,前者包括后者的是( )A、氧化物、化合物 B、化合物、非电解质 C、溶液、胶体 D、溶液、分散系7. 当光束通过下列分散系时,能观察到丁达尔效应的是( )A、蔗糖溶液 B、盐酸 C、氯化钠溶液 D、Fe(OH)3胶体8. 下列物质中,属于电解质的是( )A、CO2 B、H2 C、Na2SO4 D、Cu9. 下列化学方程式中,不能用H++OH﹣=H2O表示的是( )A、2NaOH+H2SO4═Na2SO4+2H2O B、Ba(OH)2+2HCl═BaCl2+2H2O C、KOH+HCl═KCl+H2O D、Cu(OH)2+2HNO3═Cu(NO3)2+2H2O10. 关于氧化还原反应,下列说法不正确的是( )A、氧化反应和还原反应一定同时发生 B、一定有单质参加反应 C、反应前后一定有元素的化合价发生变化 D、氧化剂一定是反应过程中得到电子的物质11. 下列各组离子,在溶液中可以大量共存且为无色的是( )A、Ag+、Cu2+、Cl﹣、NO3﹣ B、Fe2+、NH4+、CO32﹣、OH﹣ C、Na+、Cl﹣、K+、OH﹣ D、H+、K+、Fe3+、NO3﹣12. 下列各溶液中,Na+物质的量浓度最大的是( )A、2L 0.5mol/L NaCl溶液 B、3L 0.3mol/L Na2SO4溶液 C、1L0.4mol/L Na2CO3溶液 D、4L 0.15mol/L Na3PO4溶液13. 下列离子方程式书写正确的是( )A、氢氧化钠溶液和稀盐酸反应:H++OH﹣═H2O B、大理石与盐酸反应制取二氧化碳:CO32﹣+2H+═H2O+CO2↑ C、铁粉投入盐酸溶液中:2Fe+6H+═Fe3++3H2↑ D、用小苏打治疗胃酸过多:CO32﹣+2H+═CO2↑+H2O14. 瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为( )A、1:4 B、1:2 C、1:1 D、2:115. 下列各组反应中,不能用同一个离子方程式表示的是( )A、盐酸分别与NaOH溶液、Ca(OH)2溶液反应 B、锌分别与稀盐酸、稀硫酸反应 C、硝酸分别与Na2CO3溶液、K2CO3溶液反应 D、硫酸分别与NaOH溶液、Ba(OH)2溶液反应16. 氢气还原氧化铜:CuO+H2 Cu+H2O,在该反应中( )A、Cu做还原剂 B、H2做氧化剂 C、铜元素的化合价降低 D、铜元素化合价升高17. 下列说法正确的是( )A、32gO2占有的体积约为22.4L B、a L甲烷和乙烷混合气体中的分子数约为 ×6.02×1023 C、在标准状况下,22.4L水的质量约为18g D、22g二氧化碳与标准状况下的11.2L HCl含有相同的分子数18. 分离四氯化碳和甲苯的混合物(两者互溶,沸点分别为76.75℃和110.6℃),可选用的分离方法为( )A、萃取法 B、蒸馏法 C、结晶法 D、分液法19. 将6.0mol•L﹣1 H2SO4溶液由10mL稀释至200mL,再从中取出20mL,这20mL溶液的物质的量浓度是( )A、0.05mol•L﹣1 B、0.30 mol•L﹣1 C、0.15 mol•L﹣1 D、0.5 mol•L﹣120. 下列变化需要加入还原剂才能实现的是( )A、Fe3+→Fe2+ B、HCl→Cl2 C、Fe→Fe2+ D、C→CO221. 下列电离方程式错误的是( )A、Ba(OH)2═Ba2++2OH﹣ B、NaHSO4═H++Na++SO42﹣ C、MgCl2═Mg2++2Cl﹣ D、NaHCO3═H++Na++CO32﹣22. 设NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、1molH2O所含有的原子数为NA B、32gO2含有的氧原子数为2NA C、常温常压下,11.2 LCl2 所含的分子数为0.5NA D、1L0.1mol/LNaCl溶液中所含的Na+数为NA23. 现有三组溶液,①碘水中提取单质碘 ②碘和四氯化碳的混合物 ③汽油和氯化钠溶液,分离以上混合物的正确方法依次是( )A、分液、萃取、蒸馏 B、萃取、蒸馏、分液 C、分液、蒸馏、萃取 D、蒸馏、萃取、分液24. 浊液区别于其他分散系最本质的特征是( )A、外观浑浊不清 B、浊液没有丁达尔现象 C、不稳定 D、分散质粒子直径大于100nm25. 过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序是( )
A、②③①⑤④ B、①②③⑤④ C、③①②④⑤ D、①⑤②③④26. 下列各组离子,在强碱性溶液中可以大量共存的是( )A、Cu2+、Ba2+、Cl﹣、SO42﹣ B、Na+、Ba2+、Cl﹣、NO3﹣ C、Mg2+、K+、Cl﹣、NO3﹣ D、Na+、K+、NO3﹣、H+27. 下列反应中铁元素被还原的是( )A、2Fe(OH)3 Fe2O3+3H2O B、Fe+CuSO4=Cu+FeSO4 C、Fe(OH)3+3HCl=FeCl3+3H2O D、2Fe2O3+3C 4Fe+3CO2↑28. 在标准状况下,若VL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )A、 B、 C、 D、29. NA代表阿伏伽德常数,下列说法中,正确的是( )A、在同温同压时,相同体积的任何气体单质所含的原子数目相同 B、2 g氢气所含原子数目为NA C、在常温常压下,11.2 L氮气所含的原子数目为NA D、17 g氨气所含原子数目为4 NA30. 在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是( )A、1:2 B、2:1 C、2:3 D、3:2二、解答题
-
31. 现有下列几种物质:
①蔗糖 ②熔融NaCl ③盐酸 ④铜丝 ⑤NaOH固体 ⑥液态HCl⑦H2SO4⑧CO2⑨食盐水
(1)、上述物质中可导电的是 (填序号,下同).(2)、上述物质中属于电解质的是 .32. 写出下列反应的离子方程式.(1)、碳酸钡(BaCO3)和盐酸反应: .(2)、H2SO4溶液与Ba(OH)2溶液反应: .(3)、Fe与稀硫酸溶液反应: .(4)、氧化镁(MgO)与稀硝酸(HNO3)反应: .(5)、写出一个符合离子反应的化学方程式:CO32﹣+Ca2+=Ca CO3↓(6)、写出NaHCO3的电离方程式 .33. 现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:
(1)、上述仪器中,在配制稀H2SO4时不需要使用的有(填代号),还缺少的仪器是 .(2)、经计算,需量取浓H2SO4的体积为 mL.(3)、配制步骤:量取浓硫酸,小心地倒入盛有少量蒸馏水的烧杯中,搅拌均匀,待冷却至室温后转移到100mL容量瓶中,用少量的蒸馏水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加入蒸馏水至刻度线,定容,塞好瓶塞,反复上下颠倒摇匀.①定容的正确操作是继续加蒸馏水至离刻度线下时,改用胶头滴管加水至凹液面最低处与刻度线相切.
②用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是(填序号).
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制
(4)、配制时下列操作会导致所配溶液浓度偏高的是 .a.转移时有少量溶液溅出 b.定容时俯视刻度线
c.容量瓶用蒸馏水洗净后未干燥 d.用量筒量取浓硫酸时,俯视刻度线
e.稀释后未经冷却就转移定容
(5)、图是该同学转移溶液的示意图,其中的错误是 .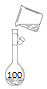 34. 标准状况下,CO2分子数为6.02×1022 , 氧原子的物质的量为 , CO2的体积为 .
34. 标准状况下,CO2分子数为6.02×1022 , 氧原子的物质的量为 , CO2的体积为 .