山东省潍坊市2020-2021学年高一上学期化学期末考试试卷
试卷更新日期:2021-03-25 类型:期末考试
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
-
1. 水饺是中华传统美食,制作过程如下图所示。下列说法错误的是( )
 A、和面的过程使用苏打作为膨松剂 B、调馅所用食盐的主要成分属于电解质 C、笊篱捞饺子利用了过滤操作原理 D、饺子汤过滤后所得滤液能产生丁达尔现象2. 自然界中氮的循环如图所示。下列说法错误的是( )
A、和面的过程使用苏打作为膨松剂 B、调馅所用食盐的主要成分属于电解质 C、笊篱捞饺子利用了过滤操作原理 D、饺子汤过滤后所得滤液能产生丁达尔现象2. 自然界中氮的循环如图所示。下列说法错误的是( ) A、工业合成氨属于人工固氮 B、氨和铵盐在硝化细菌作用下发生氧化还原反应 C、扩大豆科植物的栽种面积可降低活化氮的量 D、含氮无机物与有机氮可相互转化3. 下列说法正确的是( )A、足量铁与氯气反应可得FeCl2 B、正交硫与单斜硫的化学性质不同 C、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 D、钠与浓NH4Cl溶液反应,放出的气体中含有H2和NH34. 实验室制取并收集氨气。下列装置能达到实验目的的是( )A、制取NH3
A、工业合成氨属于人工固氮 B、氨和铵盐在硝化细菌作用下发生氧化还原反应 C、扩大豆科植物的栽种面积可降低活化氮的量 D、含氮无机物与有机氮可相互转化3. 下列说法正确的是( )A、足量铁与氯气反应可得FeCl2 B、正交硫与单斜硫的化学性质不同 C、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 D、钠与浓NH4Cl溶液反应,放出的气体中含有H2和NH34. 实验室制取并收集氨气。下列装置能达到实验目的的是( )A、制取NH3 B、干燥NH3
B、干燥NH3  C、收集NH3
C、收集NH3  D、吸收NH3
D、吸收NH3  5. 下列物质不能由两种单质直接反应生成的是( )A、CuS B、NO C、Na2O D、SO26. 常温下,下列实验能发生化学反应,却始终无明显现象的是( )A、向FeSO4溶液中通入NO2 B、向浓硫酸溶液中加入铜片 C、向NaHCO3溶液中通入NH3 D、向H2S溶液中通入SO27. 对于下列实验,不能正确表示其反应的离子方程式是( )A、向热KOH溶液中加入少量NH4HCO3粉末: B、向澄清石灰水中滴加Na2CO3溶液:Ca2++ =CaCO3↓ C、向FeCl3溶液中加入KI溶液:Fe3++2I-=Fe2++I2 D、向NaClO溶液中滴加盐酸:ClO-+2H++Cl-=Cl2↑+H2O8. 对下列事实的解释中,错误的是( )A、附着在试管内壁上的硫可用CS2洗涤,说明硫易溶于CS2 B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 C、向某溶液中加足量稀盐酸无现象,再加BaCl2溶液产生白色沉淀,说明该溶液中一定有 D、常温下浓硫酸可以用铁质容器贮存,说明铁与浓硫酸不反应9. NA表示阿伏加德罗常数的数值。下列说法正确的是( )A、标准状况下,11.2LH2O中原子数目为1.5NA B、常温常压下,0.1mol·L-1的氨水中NH4+、NH3、NH3·H2O三种微粒的数目为0.1NA C、常温常压下,将1molCl2通入足量水中充分反应转移电子数目小于NA D、标准状况下,3.8gNO与NO2混合气体中分子数目为0.05NA10. 某同学设计如图所示实验,探究Fe与稀硝酸、稀硫酸的反应。实验过程中发现①、③中产生的气体在试管口处变为红棕色。
5. 下列物质不能由两种单质直接反应生成的是( )A、CuS B、NO C、Na2O D、SO26. 常温下,下列实验能发生化学反应,却始终无明显现象的是( )A、向FeSO4溶液中通入NO2 B、向浓硫酸溶液中加入铜片 C、向NaHCO3溶液中通入NH3 D、向H2S溶液中通入SO27. 对于下列实验,不能正确表示其反应的离子方程式是( )A、向热KOH溶液中加入少量NH4HCO3粉末: B、向澄清石灰水中滴加Na2CO3溶液:Ca2++ =CaCO3↓ C、向FeCl3溶液中加入KI溶液:Fe3++2I-=Fe2++I2 D、向NaClO溶液中滴加盐酸:ClO-+2H++Cl-=Cl2↑+H2O8. 对下列事实的解释中,错误的是( )A、附着在试管内壁上的硫可用CS2洗涤,说明硫易溶于CS2 B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 C、向某溶液中加足量稀盐酸无现象,再加BaCl2溶液产生白色沉淀,说明该溶液中一定有 D、常温下浓硫酸可以用铁质容器贮存,说明铁与浓硫酸不反应9. NA表示阿伏加德罗常数的数值。下列说法正确的是( )A、标准状况下,11.2LH2O中原子数目为1.5NA B、常温常压下,0.1mol·L-1的氨水中NH4+、NH3、NH3·H2O三种微粒的数目为0.1NA C、常温常压下,将1molCl2通入足量水中充分反应转移电子数目小于NA D、标准状况下,3.8gNO与NO2混合气体中分子数目为0.05NA10. 某同学设计如图所示实验,探究Fe与稀硝酸、稀硫酸的反应。实验过程中发现①、③中产生的气体在试管口处变为红棕色。
下列说法正确的是( )
A、②中大量存在的离子有Fe2+、 、H+ B、①、③产生气体的组成可能不同 C、③溶液中一定既含有Fe2+ , 又含有Fe3+ D、实验结论:稀硫酸的氧化性大于稀硝酸二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
-
11. 根据实验操作及现象得出的结论正确的是( )
选项
实验操作及现象
结论
A
将充满氨气的试管倒置于滴有酚酞的水槽中,试管内迅速充满红色液体
NH3极易溶于水且溶液显碱性
B
蔗糖中加入浓硫酸出现发黑现象
浓硫具有吸水性和强氧化性
C
向酸性KMnO2溶液中通入SO2 , 溶液褪色
SO2有漂白性
D
向某盐溶液中加入NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝
该溶液中含有
A、A B、B C、C D、D12. 在不同条件下,用O2氧化一定浓度的FeCl2溶液,其实验数据如图所示。下列说法错误的是( ) A、实验过程中,溶液颜色逐渐加深 B、由①和③可知,温度越高,Fe2+氧化越快 C、由②和③可知,pH越大,Fe2+氧化越快 D、温度低、pH小,有利于FeCl2溶液的保存13. 一种锂离子电池的正极材料中含钴酸锂(LiCoO2)。某离子反应涉及到H2O、H2O2、O2、CoO2、H+、Co2+等微粒,溶液中CoO2、O2的物质的量随时间变化的曲线如下图所示。下列说法错误的是( )
A、实验过程中,溶液颜色逐渐加深 B、由①和③可知,温度越高,Fe2+氧化越快 C、由②和③可知,pH越大,Fe2+氧化越快 D、温度低、pH小,有利于FeCl2溶液的保存13. 一种锂离子电池的正极材料中含钴酸锂(LiCoO2)。某离子反应涉及到H2O、H2O2、O2、CoO2、H+、Co2+等微粒,溶液中CoO2、O2的物质的量随时间变化的曲线如下图所示。下列说法错误的是( ) A、反应中的还原剂是H2O2 B、氧化性:LiCoO2>O2 C、氧化剂与还原剂物质的量之比为2:1 D、若反应生成2.24L(标准状况)O2 , 转移电子0.4mol14. 工业上用亚铬酸亚铁[Fe(CrO2)2 ]制备K2Cr2O7晶体的部分工艺流程如下所示:
A、反应中的还原剂是H2O2 B、氧化性:LiCoO2>O2 C、氧化剂与还原剂物质的量之比为2:1 D、若反应生成2.24L(标准状况)O2 , 转移电子0.4mol14. 工业上用亚铬酸亚铁[Fe(CrO2)2 ]制备K2Cr2O7晶体的部分工艺流程如下所示:
已知:4Fe(CrO2)2+10Na2CO3 +7O2 8Na2CrO4+4NaFeO2+10CO2
2H++2 = +H2O
下列说法正确的是( )
A、“高温氧化”过程中只有Cr元素被氧化 B、“酸化”的主要目的是使Na2CrO4转变为Na2Cr2O7 C、“滤渣”的主要成分是Na2SO4和Na2CO3 D、生成K2Cr2O7的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl15. 为探究铍及其氧化物的性质,进行如下实验(铍片规格相同):实验操作
实验现象
实验原理
①向盛有铍片的试管中加入足量6mol·L-1盐酸
开始无现象,一段时间后铍片逐渐溶解,并有大量气泡产生
BeO+2HCl=BeCl2+H2O Be+2HCl=BeCl2+H2↑
②向盛有铍片的试管中加入足量3mol·L-1硫酸溶液
开始无现象,一段时间后,铍片表面缓慢放出少量气泡
BeO+ H2SO4=BeSO4+H2O Be+H2SO4=BeSO4+H2↑
③向盛有铍片的试管中加入足量6mol·L-1氢氧化钠溶液
开始无现象,一段时间后铍片逐渐溶解,并有大量气泡产生
BeO+2NaOH=Na2BeO2+H2O Be+2NaOH=Na2BeO2+H2↑
下列说法错误的是( )
A、实验开始均无现象原因是:Be在空气中形成氧化膜 B、根据实验可知:BeO既有碱性氧化物的性质,又有酸性氧化物的性质 C、对比实验①、②可知:c(H+)越大,相同时间内产生气泡越多 D、对比实验①、②可知:Cl-对Be与H+的反应可能有促进作用三、非选择题:本题共5小题,共60分。
-
16. 电子工业中,常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。化学实验小组从腐蚀废液(含FeCl3、FeCl2、CuCl2)中回收铜并重新获得FeCl3晶体的流程如下:

回答下列问题:
(1)、检验腐蚀废液中含有Fe3+常用的试剂是。(2)、滤渣的成分是(填化学式)。从滤渣中获得铜单质,可选用的试剂是(填标号)。A.稀盐酸
B.浓硫酸
C.稀硝酸
D.氯化铜溶液
(3)、向溶液a中通入Cl2发生反应的离子方程式为。有同学建议,使用H2O2代替Cl2以减少污染,则反应中氧化剂与还原剂的物质的量之比为。
(4)、甲同学用酸性KMnO4溶液检验溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是(用离子方程式表示)。17. 某化学实验小组同学用如图所示装置制备NO2 , 并探究NO2与水反应的产物(夹持装置略、装置气密性良好、所有阀门关闭)。回答下列问题: (1)、步骤①:打开K1和 , 通入N2 , 一段时间后关闭K1。
(1)、步骤①:打开K1和 , 通入N2 , 一段时间后关闭K1。步骤②:向锥形瓶中加入浓HNO3 , 其操作方法是。
步骤③:证明三颈烧瓶中反应有NO生成,操作是 , 现象是。
步骤④:传感器数据显示c( NO3- )随反应时间逐渐增大,证明NO2与水反应生成 NO3- 。
(2)、甲同学认为步骤④的结论有缺陷,该同学的判断依据是 。(3)、乙同学查阅资料得知反应后三颈烧瓶溶液中可能含有HNO2。证明HNO2存在的实验方案是。18. 山东省率先实现空气质量自动监测四级数据覆盖与共享。某科研小组测定空气中SO2含量的过程如下:已知:品红能溶于乙醇等溶剂。
回答下列问题:
(1)、向品红水溶液中通入足量SO2 , 现象是。经查阅资料知,不是SO2导致上述现象,验证该结论可使用的试剂是。
(2)、用如图所示装置检测空气中SO2的含量。
①配制1000mL5 ×10-3 mol·L-1的碘溶液,需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、 。
②将配制的溶液稀释10倍,量取5mL注人试管,加入2-3滴淀粉溶液,慢慢抽气,观察到溶液中(填实验现象)时,停止抽气,记录抽气次数n。该过程中发生反应的离子方程式为。
③空气中二氧化硫的最大允许含量为0.02mg·L-1。若每次抽空气100mL (标准状况),则n至少为次,才符合标准。抽气时应慢慢抽拉活塞,若抽拉过快,会造成测定结果(偏大、偏小、无影响)。
19. 水合肼(N2H4·H2O)是一种精细化工原料,常用于医药、农药、染料、航天等领域。实验室模拟尿素法制备N2H4·H2O,并进一步制取副产品Na2SO3的流程如图所示。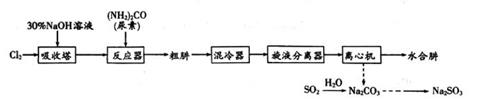
已知:①N2H4·H2O具有强还原性,易被氧化成N2。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4·H2O。
③尿素中氮元素为-3价。
回答下列问题:
(1)、吸收塔内发生反应的离子方程式为。(2)、为提高吸收塔内NaOH的有效利用率,将二氧化锰和浓盐酸制取的Cl2通入吸收塔前应进行的操作是(填操作名称),选用的试剂是。(3)、反应器内生成水合肼的化学方程式为。(4)、制备过程中要控制反应器内NaClO溶液的供给量,其主要目的是(用离子方程式表示)。(5)、副产品Na2SO3常用作还原性漂白剂。在测定某液体葡萄糖中Na2SO3残留量时,取50.00mL样品,先通入足量Cl2 , 再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式,为 , 该样品中Na2SO3残留量为g·L-1(以SO2计,结果保留1位小数)。20. 制备高铁酸钾[K2FeO4]并用其除去土壤和废水中的有机砷(HAPA)与无机砷[ +3价砷表示为As(Ⅲ)]的流程如图所示:
已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)、生成K2FeO4的化学方程式为。(2)、K2FeO4去除砷污染时做(填“氧化剂”或“还原剂”)。若污染物中的砷全部以Na3AsO3计,则去除全部污染时Na3AsO3与K2FeO4的物质的量之比为。(3)、氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。
①氢离子浓度为3×10-5mol·L-1时去除率低,原因是(用离子方程式表示)。
②最佳铁砷质量比为 , 理由是。