广东省揭阳市惠来一中2016-2017学年高一上学期化学期中考试试卷
试卷更新日期:2017-10-26 类型:期中考试
一、单项选择题
-
1. 下列实验仪器不宜直接用来加热的是( )A、试管 B、坩埚 C、蒸发皿 D、烧杯2. 下列分离、提纯、鉴别物质的方法正确的是( )A、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 D、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质3. 以下说法正确的是( )A、物质所含元素化合价升高的反应叫还原反应 B、在氧化还原反应中,失去电子的元素化合价降低 C、物质中某元素失去电子,则此物质是氧化剂 D、还原剂中必定有一种元素被氧化4. 欲配制100mL 1.0mol/L Na2CO3溶液,正确的方法是( )
①将10.6g Na2CO3溶于100mL水中
②将28.6g Na2CO3•10H2O溶于少量水中,再用水稀释至100mL
③将20mL 5.0mol/L Na2CO3溶液用水稀释至100mL.
A、①② B、②③ C、只有② D、只有③5. 下列说法正确的是( )A、摩尔是物质的数量单位 B、58.5 gNaCl溶解在1 L水中,得到溶液的物质的量浓度为1mol/L C、标况下,1 mol CCl4 所占的体积约为22.4 L D、12g12C含有的碳原子数约为6.02×1023个6. 设阿伏加德罗常数为6.02×1023mol﹣1 . 关于1mol H2O的叙述正确的是( )A、含有1mol H2 B、含有6.02×1023个水分子 C、质量为18 g/mol D、在标准状况下的体积为22.4 L7. 已知3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是( )A、16g B、32g C、64g/mol D、32g/mol8. 比较1molN2和1molNO的下列物理量:①质量 ②分子总数 ③原子总数 ④体积,其中一定相等的是( )A、① B、②③ C、①②③ D、①②③④9. 下列反应中必须加入还原剂才能进行的是( )A、Cl2→Cl﹣ B、Zn→Zn2+ C、H2→H2O D、CuO→CuCl210. 将4g NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为( )A、1mol•L﹣1 B、0.1mol•L﹣1 C、0.01mol•L﹣1 D、10mol•L﹣111. 下列事实与胶体性质无关的是( )A、在豆浆里加入盐卤做豆腐 B、盐碱地保肥能力差 C、一束平行光线照射蛋白质溶液,从侧面可以看到一束光亮的通路 D、氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀12. 下列物质中属于强电解质且能导电的是( )①氢氧化钠溶液 ②硫酸钙固体 ③铜 ④蔗糖 ⑤三氧化硫 ⑥熔融氯化钠.
A、①②⑤ B、①②⑥ C、③⑥ D、⑥13. 下列家庭实验中不涉及化学变化的是( )A、用84消毒液和洁厕灵混合得到氯气 B、用少量食醋除去水壶中的水垢 C、用糯米、酒曲和水制甜酒酿 D、用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐14. 随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止月饼等富含油脂食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,下列不属于抗氧化物质的是( )A、维生素C B、还原铁粉 C、亚硫酸钠 D、生石灰15. 下列化学方程式中,不能用H++OH﹣=H2O表示的是( )A、2NaOH+H2SO4=Na2SO4+2H2O B、Ba(OH)2+2HCl=BaCl2+2H2O C、Cu(OH)2+2HNO3=Cu(NO3)2+2H2O D、KOH+HCl=KCl+H2O16. 下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是( )A、实验室中用稀硫酸与锌粒反应制取H2 B、实验室中用高锰酸钾加热分解制取O2 C、实验室中用浓盐酸与二氧化锰加热制取Cl2 D、实验室中用稀盐酸与石灰石反应制取CO217. 下列反应中氯元素只被还原的是( )A、5Cl2+I2+6H2O=10HCl+2HIO3 B、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O C、MnO2+4HCl=MnCl2+2H2O+Cl2↑ D、2NaCl+2H2O 2NaOH+Cl2↑+H2↑18. 下列离子方程式书写正确的是( )A、硝酸银与盐酸反应:AgNO3+Cl﹣═AgCl↓+NO3﹣ B、铜片插入硝酸银溶液中:Cu+Ag+═Ag+Cu2+ C、硫酸和氯化钡溶液反应:Ba2++SO42﹣═BaSO4↓ D、铁钉放入硫酸铜溶液中:2Fe+3Cu2+═2Fe3++3Cu19. 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )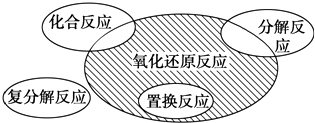 A、Cl2+2KBr═Br2+2KCl B、2NaHCO3 Na2CO3+H2O+CO2↑ C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 D、2Na2O2+2CO2═2Na2CO3+O2↑20. 下列电离方程式书写正确的是( )A、把CaO放入水中:CaO═Ca2++O2﹣ B、把NaHSO4放入水中:NaHSO4═Na++HSO42﹣ C、把Al2(SO4)3放入水中:Al2(SO4)3═Al3++SO42﹣ D、把NaHCO3放入水中:NaHCO3═Na++HCO3﹣21. 下列离子能大量共存的是( )A、使无色酚酞试液呈红色的溶液中:Na+、K+、SO42﹣、CO32﹣ B、无色透明的溶液中:Cu2+、K+、SO42﹣、NO3﹣ C、含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42﹣、Cl﹣ D、使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32﹣、NO3﹣22. 如图表示的一些物质或概念间的从属关系中不正确的是( )
A、Cl2+2KBr═Br2+2KCl B、2NaHCO3 Na2CO3+H2O+CO2↑ C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 D、2Na2O2+2CO2═2Na2CO3+O2↑20. 下列电离方程式书写正确的是( )A、把CaO放入水中:CaO═Ca2++O2﹣ B、把NaHSO4放入水中:NaHSO4═Na++HSO42﹣ C、把Al2(SO4)3放入水中:Al2(SO4)3═Al3++SO42﹣ D、把NaHCO3放入水中:NaHCO3═Na++HCO3﹣21. 下列离子能大量共存的是( )A、使无色酚酞试液呈红色的溶液中:Na+、K+、SO42﹣、CO32﹣ B、无色透明的溶液中:Cu2+、K+、SO42﹣、NO3﹣ C、含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42﹣、Cl﹣ D、使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32﹣、NO3﹣22. 如图表示的一些物质或概念间的从属关系中不正确的是( )X
Y
Z
A.
酸
含氧酸
纯净物
B.
置换反应
氧化还原反应
化学反应
C.
胶体
分散系
混合物
D.
强电解质
电解质
化合物
 A、A B、B C、C D、D23. 下列离子方程式正确的是( )A、氧化镁与稀盐酸混合:O2﹣+2 H+═H2O B、碳酸钠溶液和石灰乳反应:CO32﹣+Ca2+═CaCO3↓ C、稀硫酸与锌反应:2 H++Zn═Zn2++H2↑ D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+3H+24. 下列离子检验的方法正确的是( )A、某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl﹣ B、某溶液中先滴足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,说明原溶液中有SO42﹣ C、某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Fe3+ D、某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32﹣
A、A B、B C、C D、D23. 下列离子方程式正确的是( )A、氧化镁与稀盐酸混合:O2﹣+2 H+═H2O B、碳酸钠溶液和石灰乳反应:CO32﹣+Ca2+═CaCO3↓ C、稀硫酸与锌反应:2 H++Zn═Zn2++H2↑ D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+3H+24. 下列离子检验的方法正确的是( )A、某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl﹣ B、某溶液中先滴足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,说明原溶液中有SO42﹣ C、某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Fe3+ D、某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32﹣二、填空题
-
25. 请对以下过程形成的分散系进行分类( 用序 号作答)
①花生油加入到水中后充分搅拌;
②向蒸馏水中加入硝酸钾至恰好饱和;
③饱和氯化铁溶液中逐滴加入少量氢氧化钠溶液;
④氢氧化钡溶液中通入过量的CO2;
⑤用滤纸过滤氢氧化铁胶体后得到的滤液;
⑥将纳米材料分散在塑料中制备复合材料;
⑦碘水和酒精的混合物
属于浊液的是:;属于溶液的是:;属于胶体的是: .
26. 在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中(1)、该反应的氧化剂是 , 氧化产物是(2)、该反应的离子方程式为(3)、请用“双线桥法”标出该反应电子转移的方向和数目.(4)、该反应氧化剂与还原剂的物质的量之比为 .27. 写出下列离子方程式能表示的一个化学方程式:(1)、OH﹣+H+═H2O(2)、Cu2++2OH﹣═Cu(OH)2 .28. 将标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为;同温、同压下等质量的NO2和NO气体,它们所占的体积比为 , 所含氧元素的物质的量之比为 .29. 如图所示是分离混合物时常用的仪器,回答下列问题: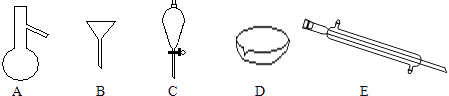 (1)、写出仪器C、E的名称、(2)、分离以下混合物应该主要选用上述什么仪器?(填字母符号)
(1)、写出仪器C、E的名称、(2)、分离以下混合物应该主要选用上述什么仪器?(填字母符号)①NaCl固体和泥沙:②花生油和水:
(3)、若向C装置中加入碘水和足量CCl4 , 充分振荡后静置,观察到现象是:C内液体分两层,上层液体色,下层液体色.(4)、碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:A、汽油 B、CCl4 C、酒精 D、醋酸.30. 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:(1)、如图所示的仪器中配制溶液肯定不需要的是(填序号),本实验所需玻璃仪器E规格为mL.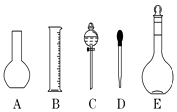 (2)、下列操作中,容量瓶所不具备的功能有 (填序号).A、配制一定体积准确浓度的标准溶液 B、长期贮存溶液 C、用来加热溶解固体溶 D、量取一定体积的液体(3)、在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L (填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.(4)、根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用 mL规格的量筒最好.31. NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图:
(2)、下列操作中,容量瓶所不具备的功能有 (填序号).A、配制一定体积准确浓度的标准溶液 B、长期贮存溶液 C、用来加热溶解固体溶 D、量取一定体积的液体(3)、在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L (填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.(4)、根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用 mL规格的量筒最好.31. NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: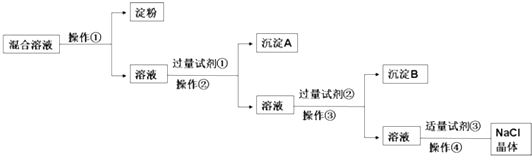 (1)、写出上述实验过程中所用试剂(写化学式):
(1)、写出上述实验过程中所用试剂(写化学式):试剂①;试剂③ .
(2)、判断试剂①已过量的方法是: .(3)、用化学方程式表示加入试剂②的作用:(4)、操作①是利用半透膜进行分离提纯.操作①的实验结果:淀粉(填“能”或“不能”)透过半透膜;SO42﹣(填“能”或“不能”)透过半透膜;请用实验证明上述结果,完成下表(可不填满,也可增加):限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸编号
实验操作
预期现象和结论
①
②
32. 已知铜和浓硫酸可以在加热条件下发生如下反应:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O试通过计算和推理完成下面的问题:
(1)、SO2物质可以使酸性KMnO4溶液褪色,此反应中(填写化学式)失去电子.(2)、足量的铜片与 含溶质1.8mol的浓H2SO4充分反应,如果该反应过程中转移了 0.2mol电子,生成的CuSO4的质量为克,生成的气体在标准状况下体积为升(假设气体全部逸出).(3)、将反应后所得到的溶液与足量Ba(OH)2溶液充分反应.请写出此过程发生的反应的离子方程式: .