初中化学人教版一轮复习考点11盐和化肥
试卷更新日期:2021-03-18 类型:一轮复习
一、单选题
-
1. 小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是( )A、CO(NH2)2 B、KCl C、KNO3 D、NH4HCO32. 工业上常用高温煅烧石灰石来制得生石灰,发生的反应为CaCO3 CaO+CO2。现取一定量的石灰石样品进行煅烧(假设杂质不变),某变量 y 随时间的变化趋势如图所示。则纵坐标表示的是( )
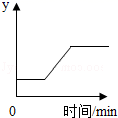 A、生成CO2的体积 B、生成CaO的质量 C、固体中杂质的质量分数 D、固体中氧元素的质量分数3. 下列实验现象描述错误的是( )A、一氧化碳还原氧化铁:红棕色固体逐渐变成银白色 B、氢氧化钠固体放置于空气中:白色固体表面潮湿并逐渐溶解 C、铜丝浸入硝酸银溶液中:紫红色固体表面有银白色固体产生,溶液由无色变为蓝色 D、熟石灰与氯化铵混合研磨:白色固体中产生有氨味的气体4. 实验室里,区分下列各组物质的两个实验设计方案都合理的是( )
A、生成CO2的体积 B、生成CaO的质量 C、固体中杂质的质量分数 D、固体中氧元素的质量分数3. 下列实验现象描述错误的是( )A、一氧化碳还原氧化铁:红棕色固体逐渐变成银白色 B、氢氧化钠固体放置于空气中:白色固体表面潮湿并逐渐溶解 C、铜丝浸入硝酸银溶液中:紫红色固体表面有银白色固体产生,溶液由无色变为蓝色 D、熟石灰与氯化铵混合研磨:白色固体中产生有氨味的气体4. 实验室里,区分下列各组物质的两个实验设计方案都合理的是( )选项
A
B
C
D
需区分的物质
生铁和钢
木炭粉和氧化铜
氯化钠和氢氧化钠
磷矿粉和碳酸氢铵
第一方案
分别取样,加入硫酸铜溶液,观察现象
分别取样,观察颜色
分别取样,分别加适量水溶解后,测温度变化
分别取样,观察颜色
第二方案
分别用磁铁吸引,观察现象
分别取样,再分别加入稀盐酸,观察现象
分别取样,分别加适量水溶解后,再加入稀盐酸,观察现象
分别取样,加入试管中,再分别加入稀盐酸,观察现象
A、A B、B C、C D、D5. 下列物质按酸、碱、盐的顺序排列的是( )。A、Mg(OH)2、CuSO4、H2CO3 B、HNO3、KOH、NaCl C、CaCO3、NaOH、H3PO4 D、H2SO4、KNO3、NaOH6. 如图中所有物质的类别均不同,连线两端的物质常温下均能反应。
下列说法正确的是( )
A、X、Y、Z分别属碱、盐、酸 B、X和Z可以是Al2O3和CaCl2 C、Y和Z可以是Na2CO3和Ca(OH)2 D、X和Y可以是NaCl和NaOH7. 区分下列各组物质的两种方法都合理的是( )选项
需区分的物质
方法一
方法二
A
18K黄金和黄金
分别滴加硝酸银溶液
加热后观察颜色
B
生铁和钢[
加入稀盐酸
加入硫酸铜溶液
C
氢氧化钠和硝酸铵
加适量水溶解后测温度变化
观察颜色
D
氯化钠溶液与饱和石灰水
通入二氧化碳气体
降低温度
A、A B、B C、C D、D8. 学校花圃所种的花卉缺乏氮元素和钾元素。如果只施用一种化肥,则应施用( )A、(NH4)2CO3 B、KNO3 C、K2SO4 D、Ca3(PO4)29. 读图识图是学习化学的重要手段。下列四个图像中不能正确反映对应变化关系的是( )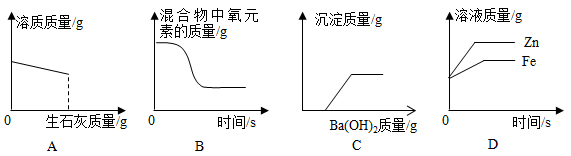 A、图A是向一定量的饱和石灰水中加入少量生石灰 B、图B是加热氯酸钾和二氧化锰的混合物制取氧气 C、图C是向一定量的稀盐酸和硫酸钠的混合溶液中加入 溶液 D、图D是将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中10. 下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )A、NaCl B、NaOH C、NaHCO3 D、Na2SO411. 向甲物质中逐滴加入X溶液至过量,生成沉淀或气体的质量与加入X溶液的质量关系不符合下图的是( )
A、图A是向一定量的饱和石灰水中加入少量生石灰 B、图B是加热氯酸钾和二氧化锰的混合物制取氧气 C、图C是向一定量的稀盐酸和硫酸钠的混合溶液中加入 溶液 D、图D是将形状相同质量相等的铁和锌分别加入到足量的质量和浓度都相等的稀硫酸中10. 下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )A、NaCl B、NaOH C、NaHCO3 D、Na2SO411. 向甲物质中逐滴加入X溶液至过量,生成沉淀或气体的质量与加入X溶液的质量关系不符合下图的是( )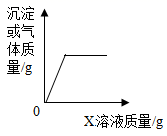
选项
甲物质
X溶液
A
盐酸和硫酸钠混合溶液
氯化钡溶液
B
盐酸和氯化铜混合溶液
氢氧化钠溶液
C
锌粉和铁粉混合物
稀硫酸
D
碳酸氢钠和氯化钠混合溶液
稀盐酸
A、A B、B C、C D、D12. 一定温度下,向a g FeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如下图所示。下列叙述错误的是( ) A、Fe(OH)3沉淀完全时消耗NaOH的质量为ng B、P点对应的溶液中 NaOH达到饱和状态 C、m=c-a D、生成Fe(OH)3的质量为(n-b+a)g13. 向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生的沉淀质量与加入的氢氧化钠溶液质量关系如图所示。下列说法错误的是( )
A、Fe(OH)3沉淀完全时消耗NaOH的质量为ng B、P点对应的溶液中 NaOH达到饱和状态 C、m=c-a D、生成Fe(OH)3的质量为(n-b+a)g13. 向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生的沉淀质量与加入的氢氧化钠溶液质量关系如图所示。下列说法错误的是( )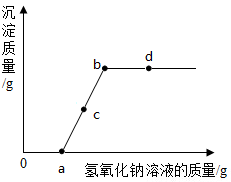 A、a点溶液中的溶质有2种 B、c点溶液中的溶质有3种 C、ab(不包括a点)段有沉淀生成 D、d点溶液的pH>714. 为鉴别氯化钠、氢氧化钠、碳酸钠和硫酸钠四种物质的溶液,设计如下实验:
A、a点溶液中的溶质有2种 B、c点溶液中的溶质有3种 C、ab(不包括a点)段有沉淀生成 D、d点溶液的pH>714. 为鉴别氯化钠、氢氧化钠、碳酸钠和硫酸钠四种物质的溶液,设计如下实验: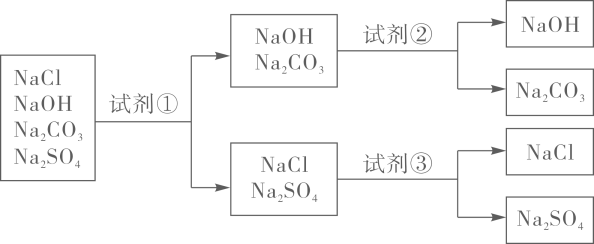
下面对试剂①、试剂②和试剂③的选择,合理的是( )
A、①酚酞②稀盐酸③氯化钡 B、①酚酞②稀盐酸③稀盐酸 C、①石蕊②氯化钡③稀盐酸 D、①石蕊②氯化钡③碳酸钠15. 现有一包固体粉末,可能是由CaCO3、Na2CO3、Na2SO4、NaCl、Ba(NO3)2中的一种或几种组成。为确定其成分,进行下列实验(微溶物质按可溶处理)。①取少量固体粉末于试管中,加足量的水溶解,静置后得到白色沉淀A和无色溶液B;
②过滤,将白色沉淀A放入试管中,滴加过量的稀硝酸,有气泡产生,沉淀部分溶解;
③取无色溶液B少许于试管中,滴加过量的稀硝酸,有气泡产生,得到溶液C;
④在溶液C中滴加硝酸银溶液,有白色沉淀产生。
以下说法正确的是( )
A、白色沉淀A的成分是BaSO4和CaCO3 B、该固体粉末中乙一定有CaCO3、Na2SO4、Na2CO3和Ba(NO3)2 C、无色溶液B中的溶质一定有NaNO3、Na2CO3和NaCl D、该固体粉末中一定有Na2SO4、Ba(NO3)2和Na2CO3 , 可能有CaCO3和NaCl二、填空题
-
16. 家庭或企业加工馒头、面包和饼干等食品时,常在面粉中加入膨松剂(如碳酸氢钠),蒸制或烘焙食品中产生大量气体,使面团疏松、多孔,制作的食品松软或酥脆,易于消化吸收。阅读上面信息后,回答:
 (1)、信息中提供的膨松剂是(填化学式);(2)、碳酸氢钠是一种性的化合物(填“可溶”或“不溶”);(3)、碳酸氢钠能使蒸制或烘焙的食品疏松多孔,原理是(用化学方程式解释)。17. 化学与我们的生活息息相关。请按要求回答下列问题。(1)、在食品工业上_____(填序号)是发酵粉的主要成分。A、食醋 B、小苏打 C、菜籽油 D、食盐(2)、厨房铁器容易生锈,主要是铁与空气中的接触而锈蚀。(3)、合理膳食有助于提高自身免疫力,你家的晚餐菜谱中已有:米饭、梁平张鸭子、清蒸鲈鱼、鸡汤。从营养角度来看,你准备再添加的一道菜是。(4)、小明家所食用的番茄来自于自家阳台上无土栽培的蔬菜。无土栽培需要使用专用的营养液。营养液配方中属于复合肥料的_____(填字母)。A、碳酸氢铵(NH4HCO3) B、磷酸二氢铵(NH4H2PO4) C、尿素[CO(NH2)2] D、硝酸钾(KNO3)
(1)、信息中提供的膨松剂是(填化学式);(2)、碳酸氢钠是一种性的化合物(填“可溶”或“不溶”);(3)、碳酸氢钠能使蒸制或烘焙的食品疏松多孔,原理是(用化学方程式解释)。17. 化学与我们的生活息息相关。请按要求回答下列问题。(1)、在食品工业上_____(填序号)是发酵粉的主要成分。A、食醋 B、小苏打 C、菜籽油 D、食盐(2)、厨房铁器容易生锈,主要是铁与空气中的接触而锈蚀。(3)、合理膳食有助于提高自身免疫力,你家的晚餐菜谱中已有:米饭、梁平张鸭子、清蒸鲈鱼、鸡汤。从营养角度来看,你准备再添加的一道菜是。(4)、小明家所食用的番茄来自于自家阳台上无土栽培的蔬菜。无土栽培需要使用专用的营养液。营养液配方中属于复合肥料的_____(填字母)。A、碳酸氢铵(NH4HCO3) B、磷酸二氢铵(NH4H2PO4) C、尿素[CO(NH2)2] D、硝酸钾(KNO3)三、实验探究题
-
18. 有一包白色粉末,含有硝酸钠、碳酸钠和硫酸钡,张南将这包白色粉末与稀盐酸(水足量)混合后,固体质量随时间变化关系如图所示。张南和小岗同学想对所得溶液溶质的成分进行实验探究,请你帮助两位同学完成如下实验及回答相关问题。
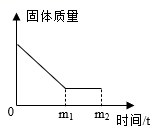
(提出问题)烧杯中溶液的溶质成分是什么?
(1)、(猜想与假设)张南同学猜想溶质成分是:NaNO3、NaCl、HCl
小岗同学猜想溶质成分是:NaNO3、NaCl、Na2CO3
你的猜想是;
张南猜想的理由是。
(2)、(实验验证)张南同学为了验证自己的猜想取少量滤液于试管中,向其中滴加少量硝酸银溶液观察到有白色沉淀的实验现象,于是得出结论:自己的猜想正确。请对张南同学由实验得出的的结论进行评价;
(3)、小岗同学取少量滤液于试管中,向其中滴加少量稀硫酸,观察到有气泡产生的实验现象,于是得出结论:同学的猜想正确。(4)、则由图像得出有关硫酸钡的性质有。(5)、(反思与总结)通过上述张南、小岗两位同学对溶液溶质成分的猜想,总结出猜想所得溶液中溶质成分时除需考虑可溶性的生成物和可溶性的反应物外,还需考虑的物质。
19. 某化学兴趣小组的同学对酸、碱和盐的性质进行探究,请你参与。[查阅资料]
20℃时,部分物质的溶解度。
物质
Ca(OH)2
NaOH
Na2CO3
NaHCO3
溶解度/g
0.16
109
21.8
9.6
(1)、探究一:探究氢氧化钙的性质20℃时,在盛有5g Ca(OH)2固体的A烧杯中加入40mL水,用玻璃棒搅拌,静置,取上层部分清液于B烧杯中。
①向A烧杯中滴加几滴酚酞溶液,观察到的现象是 , 再加入过量稀盐酸,反应的化学方程式为
②向B烧杯中通入CO2 , 观察到澄清石灰水变浑浊。
③由上述实验可知氢氧化钙的性质。
(2)、[实验拓展]向上述(1)反应后的A烧杯中滴加碳酸钠溶液,测得其pH随反应时间的变化如图。AB段的实验现象是 , BC段发生反应的化学方程式为
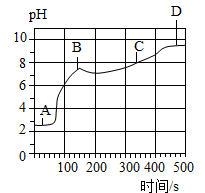 (3)、探究二:二氧化碳通入一定溶质质量分数的氢氧化钠溶液中溶质成分的探究。
(3)、探究二:二氧化碳通入一定溶质质量分数的氢氧化钠溶液中溶质成分的探究。[设计和实验] 20℃时,甲、乙两组同学设计如图装置分别进行实验。
甲组:从a端缓慢通入CO2 , 一段时间后II中变浑浊,停止通CO2 , I中溶质为X。打开活塞,滴加足量稀盐酸。
[解释与结论]
经分析X是NaHCO3。实验过程中,Ⅰ中产生的现象是
(4)、乙组:从a端缓慢通入CO2 , 一段时间后II中无明显现象,停止通CO2 , Ⅰ中溶质为Y。打开活塞,滴加足量稀盐酸,II 中变浑浊。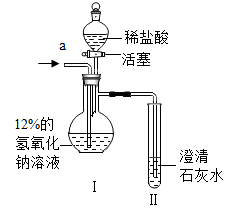
[解释与结论]
乙组同学认为Y只有Na2CO3。你认为该结论是否合理,结合分析Y的成分说明理由。I 中一定发生反应的化学方程式为。
四、综合题
-
20. 高钙片是一种人体补钙药,其有效成分是碳酸钙,工业上从石灰石(主要成分为CaCO3)获得高纯度CaCO3的流程如下:


(注:氢氧化钙[Ca(OH)2]俗称熟石灰,是重要的建筑材料)
(1)、上述生产过程中涉及的分解反应的化学方程式是:。(2)、固体A与试剂①反应的化学方程式是。(3)、气体B的用途是。(写出一种即可)(4)、写出胃酸(含盐酸)与“高钙片”中的含钙物质发生反应的化学方程式。(5)、使原料中各原子的利用率尽可能达到100%是“绿色化学”的核心理念之一。上述流程中有的物质可以再利用,流程图上还可循环利用的物质是。(写出一种即可,填化学式)五、计算题
-
21. 现有 H2SO4与CuSO4的混合溶液,为了分析混合溶液中H2SO4与CuSO4的质量分数,设计了如图实验方案:(注:硫酸铜溶液略显酸性)
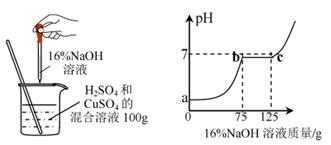 (1)、c点混合溶液与NaOH恰好反应完全,此点溶液中的溶质为(写化学式)。(2)、与硫酸铜溶液反应的氢氧化钠溶液的质量为g;请计算该混合溶液中 CuSO4的溶质质量分数(写出计算过程)。。(3)、若在100g混合溶液中不断加入上述氢氧化钠的溶液,请你画出加入氢氧化钠溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标图中作图)。
(1)、c点混合溶液与NaOH恰好反应完全,此点溶液中的溶质为(写化学式)。(2)、与硫酸铜溶液反应的氢氧化钠溶液的质量为g;请计算该混合溶液中 CuSO4的溶质质量分数(写出计算过程)。。(3)、若在100g混合溶液中不断加入上述氢氧化钠的溶液,请你画出加入氢氧化钠溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标图中作图)。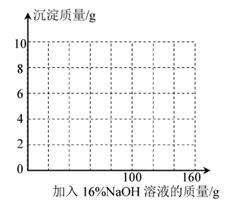 (4)、该实验方案能证明硫酸和氢氧化钠发生了中和反应的原因是。
(4)、该实验方案能证明硫酸和氢氧化钠发生了中和反应的原因是。
-