天津市南开区2020年中考化学二模试卷
试卷更新日期:2021-03-17 类型:中考模拟
一、单选题
-
1. 物质世界充满了变化。下列变化中,属于化学变化的是( )A、铁水铸锅 B、纸张燃烧 C、玻璃破碎 D、石蜡熔化2. 地壳中含量最多的金属元素是()
A、氧 B、硅 C、铝 D、铁3. 豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”、“锌”是指( )A、原子 B、分子 C、元素 D、单质4. 面粉中富含的营养素是( )A、蛋白质 B、糖类 C、油脂 D、维生素5. 下列物质常温下露置在空气中,放置一段时间后,因发生化学反应而质量增加的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠6. 下列实验操作中,正确的是( )A、滴加液体 B、稀释浓硫酸
B、稀释浓硫酸 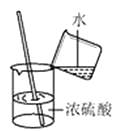 C、检查气密性
C、检查气密性  D、熄灭酒精灯
D、熄灭酒精灯 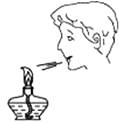 7. 锌铬黄(ZnCrO4)常用于制防锈涂料。锌铬黄中铬(Cr)元素的化合价为( )A、+6 B、+5 C、+2 D、+18. 下列说法正确的是( )A、红磷在空气中燃烧产生大量白雾 B、铁丝伸入盛有氧气的集气瓶中剧烈燃烧 C、氢氧化钠溶于水时溶液温度降低 D、镁与盐酸反应放出热量9. 下列对有关事实的解释中,错误的是()A、生铁和钢的性能不同﹣﹣含碳量不同 B、CO和CO2的化学性质不同﹣﹣分子构成不同 C、钠原子和钠离子化学性质不同﹣﹣质子数不同 D、金刚石和石墨的物理性质不同﹣﹣原子排列方式不同10. 某无色气体可能含有CH4、CO、H2中的一种或几种,依次进行下列实验(假设每步反应或吸收均完全):①无色气体在足量氧气中燃烧;②燃烧生成的气体通过盛有浓硫酸的洗气瓶,装置增重36g;③再将剩余气体通过盛有NaOH溶液的洗气瓶,装置增重44g。下列推断正确的是( )A、该气体可能只含有CH4、CO B、该气体的组成情况最多有两种 C、该气体一定只含有CH4 D、该气体可能只含有CO、H211. 下列实验方案中,你认为能达到实验目的的是( )
7. 锌铬黄(ZnCrO4)常用于制防锈涂料。锌铬黄中铬(Cr)元素的化合价为( )A、+6 B、+5 C、+2 D、+18. 下列说法正确的是( )A、红磷在空气中燃烧产生大量白雾 B、铁丝伸入盛有氧气的集气瓶中剧烈燃烧 C、氢氧化钠溶于水时溶液温度降低 D、镁与盐酸反应放出热量9. 下列对有关事实的解释中,错误的是()A、生铁和钢的性能不同﹣﹣含碳量不同 B、CO和CO2的化学性质不同﹣﹣分子构成不同 C、钠原子和钠离子化学性质不同﹣﹣质子数不同 D、金刚石和石墨的物理性质不同﹣﹣原子排列方式不同10. 某无色气体可能含有CH4、CO、H2中的一种或几种,依次进行下列实验(假设每步反应或吸收均完全):①无色气体在足量氧气中燃烧;②燃烧生成的气体通过盛有浓硫酸的洗气瓶,装置增重36g;③再将剩余气体通过盛有NaOH溶液的洗气瓶,装置增重44g。下列推断正确的是( )A、该气体可能只含有CH4、CO B、该气体的组成情况最多有两种 C、该气体一定只含有CH4 D、该气体可能只含有CO、H211. 下列实验方案中,你认为能达到实验目的的是( )选项
实验目的
实验方案
A
分离碳酸钠和氢氧化钠的混合物
加入过量氢氧化钙溶液,过滤
B
除去氯化钠固体中的少量碳酸钠
加入适量稀盐酸,充分反应后,蒸发
C
检验二氧化碳气体中含有的少量杂质气体是否为一氧化碳
将混合气体依次通过灼热的氧化铜和澄清石灰水,观察澄清石灰水的变化
D
探究二氧化锰是否为过氧化氢分解的催化剂
向溶质的质量分数为5%的过氧化氢溶液中加入少量二氧化锰,观察产生气泡情况
A、A B、B C、C D、D12. 向某盐酸和氯化镁的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液质量的关系如图所示。下列说法正确的是( ) A、a点时,溶液pH>7 B、c点时,溶液中含有两种溶质 C、b点时,溶液质量比原混合溶液质量小 D、d点时,整个反应过程消耗的氢氧化钠溶液质量为8g
A、a点时,溶液pH>7 B、c点时,溶液中含有两种溶质 C、b点时,溶液质量比原混合溶液质量小 D、d点时,整个反应过程消耗的氢氧化钠溶液质量为8g二、多选题
-
13. 下列说法中正确的是( )A、铝的金属活动性比铁强,因此铝制品比铁制品更容易锈蚀 B、铵态肥料与草木灰混用,会降低肥效 C、滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污 D、蜡烛在氧气中比在空气中燃烧更旺,说明燃烧剧烈程度与氧气的浓度有关14. 以金红石(主要成分是TiO2)为原料生产金属钛的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到TiCl4和一种可燃性气体;②在稀有气体环境和加热条件下,用Mg与TiCl4反应得到Ti和MgCl2;下列说法错误的是( )A、①中的反应为 B、反应②中稀有气体的作用是隔绝空气 C、反应①②中钛元素的化合价均发生改变 D、反应②中金属的总质量保持不变15. 下列说法正确的是( )A、镁和金属X的混合物共2.4g加入足量的稀硫酸,充分反应后得到0.22g氢气,则金属X可能是Zn B、t℃某饱和的氢氧化钙溶液加入少量的生石灰,充分反应后,恢复到t℃,则溶液的溶质质量分数不变 C、农业科研实验室用一定量的NH4NO3和KH2PO4的固体混合物配制无土栽培营养液,已知固体混合物中氮元素的质量分数为28%,则固体混合物中KH2PO4的质量分数为20% D、某样品含有氢氧化钾、碳酸钾和水三种物质。室温下,向该样品中加入浓度为14.6%的稀盐酸100g,恰好完全反应得到中性溶液,蒸干该溶液得到固体质量为7.45g
三、填空题
-
16. 化学与我们的生活密切相关。现有①稀硫酸②小苏打③氯化钠④甲烷⑤氮气⑥活性炭,从中选择适当的物质按下列要求填空(填序号):(1)、可用于冰箱除味剂的是。(2)、可用于金属表面除锈的是。(3)、焊接金属时常用作保护气的是。(4)、可用于配制生理盐水的是。(5)、发酵粉主要成分之一的是。(6)、天然气的主要成分是。17. 水是一种重要的自然资源,是生活、生产必不可少的物质。请回答下列问题:(1)、下图所示电解水的实验中,试管a中产生的气体为 , 该反应的化学方程式为。
 (2)、生活中可用检验硬水和软水。(3)、向浑浊的天然水中加入明矾,静置一段时间后,取上层液体过滤,过滤操作中用到的玻璃仪器有烧杯、玻璃棒、(填仪器的名称),其中玻璃棒的作用是。(4)、如下图所示是利用海水提取粗盐的过程,图中①是池(填“蒸发”或“冷却”)。
(2)、生活中可用检验硬水和软水。(3)、向浑浊的天然水中加入明矾,静置一段时间后,取上层液体过滤,过滤操作中用到的玻璃仪器有烧杯、玻璃棒、(填仪器的名称),其中玻璃棒的作用是。(4)、如下图所示是利用海水提取粗盐的过程,图中①是池(填“蒸发”或“冷却”)。 18. 在宏观、微观和符号之间建立联系是化学特有的思维。回答下列问题:(1)、如图是钠元素与氯元素在元素周期表中的信息和与其相关的粒子结构示意图。
18. 在宏观、微观和符号之间建立联系是化学特有的思维。回答下列问题:(1)、如图是钠元素与氯元素在元素周期表中的信息和与其相关的粒子结构示意图。
①氯原子核外电子数为。
②氯化钠是由图中(填字母编号)构成的。
③氧和氯两种元素最本质的区别是它们原子中的不同。
(2)、尿素(CO(NH2)2)是一种常用的化肥,工业上生产尿素的反应的微观示意图如下:
①尿素由(填数字)种元素组成,属于肥。
②生产尿素的反应中,参加反应的A与B的质量比为。
19. 写出下列反应的化学方程式:(1)、镁在氧气中燃烧。(2)、高温煅烧石灰石。(3)、碳酸氢钠和稀盐酸反应。20. 下表是硝酸钾和氯化铵在不同温度时的溶解度。分析表中数据,回答问题。温度/℃
0
20
40
60
溶解度/g
硝酸钾
13.3
31.6
63.9
110
氯化铵
29.4
37.2
45.8
55.2
 (1)、上图中,甲可表示(填化学式)的溶解度曲线。(2)、40℃时,两种物质的饱和溶液中,溶质质量分数较小的是(填化学式)。(3)、20℃时,按下图所示操作,B中溶液的溶质与溶剂质量比为(填最简整数比);C中的溶液是(填“饱和”或“不饱和”)溶液。
(1)、上图中,甲可表示(填化学式)的溶解度曲线。(2)、40℃时,两种物质的饱和溶液中,溶质质量分数较小的是(填化学式)。(3)、20℃时,按下图所示操作,B中溶液的溶质与溶剂质量比为(填最简整数比);C中的溶液是(填“饱和”或“不饱和”)溶液。 (4)、60℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到60℃,剩余溶液的质量:硝酸钾溶液(填“>”“<”或“=”)氯化铵溶液。(5)、室温下,将盛有硝酸钾的饱和溶液的试管放入盛有水的烧杯中,再向烧杯内的水中加入一定量的硝酸铵并搅拌,试管内可以观察到的现象是。21. 金属材料广泛应用于生产生活中。(1)、下列金属制品中,利用金属导热性的是(填字母)。
(4)、60℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到60℃,剩余溶液的质量:硝酸钾溶液(填“>”“<”或“=”)氯化铵溶液。(5)、室温下,将盛有硝酸钾的饱和溶液的试管放入盛有水的烧杯中,再向烧杯内的水中加入一定量的硝酸铵并搅拌,试管内可以观察到的现象是。21. 金属材料广泛应用于生产生活中。(1)、下列金属制品中,利用金属导热性的是(填字母)。A 金属硬币 B 铝制导线 C 铜制火锅
(2)、将纯铝和铝合金相互刻画,纯铝上留下了明显的划痕,说明。(3)、有X、Y、Z三种金属,只有Z常温下能与氧气反应。若把X、Y分别放入稀硫酸中,Y表面出现大量气泡而X表面无明显变化,则以下反应定不能发生的是(填字母)。A
B
C
D
(4)、钢铁易生锈。汽车在喷漆前可用盐酸“酸洗”,以除去钢铁表面的铁锈,此反应的化学方程式为。(5)、铝热剂是修建铁路时常用的焊接材料,其反应原理是在高温下,铝与四氧化三铁反应得到熔融的铁与一种氧化物,该反应的化学方程式为。(6)、向硝酸铜、硝酸银和硝酸镁的混合溶液中加入一定质量的金属锌,充分反应后过滤,得到滤渣和滤液。以下推断错误的是。A 若滤液为蓝色,则滤渣中一定有银,可能有铜
B 若向滤液中加入稀盐酸无白色沉淀生成,则滤液中一定有硝酸镁、硝酸锌
C 若向滤渣中加入稀盐酸有气泡生成,则滤液中只含有硝酸镁和硝酸锌
D 若反应前加入的金属锌的质量和反应后滤渣的质量相等,则滤渣中一定不含锌
四、推断题
-
22. A-J表示初中化学常见的物质,其中A、F、D为单质;铅酸蓄电池中含有E;G由三种元素组成,其固体可做某些气体的干燥剂;H是蓝色沉淀,各物质间相互转化关系如图所示。请回答下列问题:
 (1)、物质E的化学式为。(2)、反应①的化学方程式为。(3)、反应③的化学方程式为 , 该反应的基本反应类型是反应。23. 某化学兴趣小组的同学在老师的指导下,进行如下实验活动。(1)、I.用98%的浓硫酸(p=1.84g/cm3)配制100g10%的硫酸,所需浓硫酸的体积为mL(计算结果精确到0.1);量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 10%(填“>”“<”或“=”)。(2)、Ⅱ.有一包固体粉末,可能含有硝酸钾、氯化钠、碳酸钠、硫酸钠、硫酸铜中的一种或几种为探究该固体粉末的组成,小组同学取50g样品按如下流程进行实验:
(1)、物质E的化学式为。(2)、反应①的化学方程式为。(3)、反应③的化学方程式为 , 该反应的基本反应类型是反应。23. 某化学兴趣小组的同学在老师的指导下,进行如下实验活动。(1)、I.用98%的浓硫酸(p=1.84g/cm3)配制100g10%的硫酸,所需浓硫酸的体积为mL(计算结果精确到0.1);量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 10%(填“>”“<”或“=”)。(2)、Ⅱ.有一包固体粉末,可能含有硝酸钾、氯化钠、碳酸钠、硫酸钠、硫酸铜中的一种或几种为探究该固体粉末的组成,小组同学取50g样品按如下流程进行实验:
根据上述实验现象及数据,回答下列问题:
由上述实验现象及数据分析,原固体粉末中一定不含有(填化学式),一定含有(填化学式)。
滤液D中共含有(填数字)种溶质。
原固体粉末中含量最少的物质的质量为g。
五、实验题
-
24. 请结合下列实验装置,回答有关问题。
 (1)、写出图中仪器a的名称:。(2)、实验室用加热氯酸钾和二氧化锰的混合物制取并收集氧气,选用的装置为(填字母),该反应的化学方程式为。(3)、实验室用石灰石和稀盐酸反应制取并收集二氧化碳,选用的装置为(填字母),该反应的化学方程式为。(4)、如图所示实验中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球,观察到的现象是④比①先变红,②、③不变红,该实验能说明二氧化碳。
(1)、写出图中仪器a的名称:。(2)、实验室用加热氯酸钾和二氧化锰的混合物制取并收集氧气,选用的装置为(填字母),该反应的化学方程式为。(3)、实验室用石灰石和稀盐酸反应制取并收集二氧化碳,选用的装置为(填字母),该反应的化学方程式为。(4)、如图所示实验中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球,观察到的现象是④比①先变红,②、③不变红,该实验能说明二氧化碳。
六、计算题