2016年福建省厦门市中考化学试卷
试卷更新日期:2016-07-21 类型:中考真卷
一、选择题(共10小题,1-5题各2分,第6-10题各3分,每题仅有一个选项符合题意)
-
1. 在地壳中含量最多的元素是( )
A、O B、Si C、Al D、Fe2. 端午节吃粽子是我国的传统习俗,闽南特色粽子的主要原料为大米、肉、海蛎干、食盐,主要原料中富含糖类物质的是( )A、肉 B、大米 C、食盐 D、海蛎干3. 下列各图所表示的化学实验操作正确的是( )
A、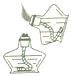 点燃酒精灯
B、
点燃酒精灯
B、 闻气体气味
C、
闻气体气味
C、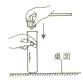 塞进橡皮塞
D、
塞进橡皮塞
D、 量筒读数
4. “●”和“○”分别代表不同元素的原子,下列各图所表示的物质属于化合物的是 ( )A、
量筒读数
4. “●”和“○”分别代表不同元素的原子,下列各图所表示的物质属于化合物的是 ( )A、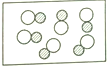 B、
B、 C、
C、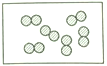 D、
D、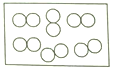 5.
5.亚硒酸钠(Na2SeO3)可用于提升人体免疫力,硒元素在元素周期表中的部分信息及原子结构示意图如图所示,下列说法正确的是( )
 A、Na2SeO3中Se的化合价为+3 B、Se是一种金属元素 C、n的值为6 D、Se相对原子质量为78.96g6. 早期治疗疟疾的原料是奎宁碱(化学式为C20H24N2O2),现在普遍使用的是我国科学家发现的青蒿素(化学式为C15H22O5),下列说法正确的是( )A、一个奎宁碱分子含有一个氧分子 B、青蒿素中碳、氢、氧三种元素的质量比是15:22:5 C、奎宁碱和青蒿素都是氧化物 D、奎宁碱和青蒿素分别在氧气中完全燃烧的产物不同7.
A、Na2SeO3中Se的化合价为+3 B、Se是一种金属元素 C、n的值为6 D、Se相对原子质量为78.96g6. 早期治疗疟疾的原料是奎宁碱(化学式为C20H24N2O2),现在普遍使用的是我国科学家发现的青蒿素(化学式为C15H22O5),下列说法正确的是( )A、一个奎宁碱分子含有一个氧分子 B、青蒿素中碳、氢、氧三种元素的质量比是15:22:5 C、奎宁碱和青蒿素都是氧化物 D、奎宁碱和青蒿素分别在氧气中完全燃烧的产物不同7.用红磷燃烧测定空气中氧气含量的实验装置如图所示,实验过程中,下列做法会使实验结果产生明显误差的是( )
 A、使用过量的红磷 B、把红磷改为蜡烛 C、恢复到实验开始前的温度才进行测量 D、不打开橡胶塞,用放大镜聚焦太阳光点燃红磷8. 建立微观和宏观之间的联系是一种科学的思维方式,下列叙述错误的是( )A、温度升高使原子之间的间隔变大,因此夏天钢轨之间的缝隙变小 B、冰和干冰的化学性质存在差异,因为构成它们的分子不同 C、当一铜块的所有原子都被移出之后,该铜块的质量只减少一部分 D、NaOH和KOH都具有碱性,其原因是在水中均能解离出OH﹣9. 为达到下列实验目的,相应的实验方案合理的是( )
A、使用过量的红磷 B、把红磷改为蜡烛 C、恢复到实验开始前的温度才进行测量 D、不打开橡胶塞,用放大镜聚焦太阳光点燃红磷8. 建立微观和宏观之间的联系是一种科学的思维方式,下列叙述错误的是( )A、温度升高使原子之间的间隔变大,因此夏天钢轨之间的缝隙变小 B、冰和干冰的化学性质存在差异,因为构成它们的分子不同 C、当一铜块的所有原子都被移出之后,该铜块的质量只减少一部分 D、NaOH和KOH都具有碱性,其原因是在水中均能解离出OH﹣9. 为达到下列实验目的,相应的实验方案合理的是( )实验目的
实验方案
A
除去铁制品表明少量的铁锈
用过量的硫酸长时间浸泡
B
除去硫酸钠溶液中少量的碳酸钠
加入稍过量的稀盐酸
C
鉴别氢气和甲烷
分别点燃,在火焰上方罩干冷烧杯
D
从氯酸钾与二氧化锰制氧后的固体中回收二氧化锰
溶解固体,过滤后对滤渣进行洗涤、烘干
A、A B、B C、C D、D10.三种物质在密闭容器中发生反应,反应前后质量比例的变化关系如图所示,下列说法正确的是( )
 A、反应中CaO为催化剂 B、该反应是复分解反应 C、反应后容器中固体质量减少 D、反应后容器中氧元素质量分数增大
A、反应中CaO为催化剂 B、该反应是复分解反应 C、反应后容器中固体质量减少 D、反应后容器中氧元素质量分数增大二、非选择题(共8小题,75分)
-
11. 中国古代文献记载了丰富的化学知识.(1)、我国是最早生产钢铁的国家这一,“百炼成钢”是指将生铁转化为钢,其主要原理是降低生铁中(填符号)元素的含量;(2)、
黑火药是我国的“四大发明”之一,爆炸时发生的主要反应如下,请完成配平(在方框内配上计量数,计量数“1”也要写):KNO3+S+C
 K2S+N2↑+CO2↑.(3)、我国是最早采用湿法冶铜的国家,文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜,写出反应的化学方程式:;(4)、古诗“投泥泼水愈光明”:在高温条件下,炭与水蒸气反应得到两种可燃性气体,写出反应的化学方程式 .12.
K2S+N2↑+CO2↑.(3)、我国是最早采用湿法冶铜的国家,文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜,写出反应的化学方程式:;(4)、古诗“投泥泼水愈光明”:在高温条件下,炭与水蒸气反应得到两种可燃性气体,写出反应的化学方程式 .12.如图是燃料在使用过程做的碳循环示意图:
 (1)、除了燃料燃烧释放大量CO2外,常见释放CO2的途径还有 , 空气中的CO2含量增多导致的后果是;(2)、利用海水进行碳储存,可以缓解空气中CO2过多的问题,写出水吸收CO2发生反应的化学方程式:;CO2可较长时间存在于深海,其原因是;(3)、
(1)、除了燃料燃烧释放大量CO2外,常见释放CO2的途径还有 , 空气中的CO2含量增多导致的后果是;(2)、利用海水进行碳储存,可以缓解空气中CO2过多的问题,写出水吸收CO2发生反应的化学方程式:;CO2可较长时间存在于深海,其原因是;(3)、科学家采取“组合转化”技术,将CO2转化为化工原料,其反应的化学方程式:2CO2+6X
 C2H4+4H2O,则X的化学式为;(4)、生物燃料(如酒精)可来源于植物体,写出酒精燃烧的化学方程式:;结合如图信息,从碳循环角度说出生物燃料的优点有 .13.
C2H4+4H2O,则X的化学式为;(4)、生物燃料(如酒精)可来源于植物体,写出酒精燃烧的化学方程式:;结合如图信息,从碳循环角度说出生物燃料的优点有 .13.水者,万物之本.
 (1)、水的组成:电解水实验装置如图1所示,可用检验与正极相连的玻璃管内产生的气体,写出电解水的化学方程式;(2)、水的用途:水是常用的溶剂.
(1)、水的组成:电解水实验装置如图1所示,可用检验与正极相连的玻璃管内产生的气体,写出电解水的化学方程式;(2)、水的用途:水是常用的溶剂.①农业生产中,用质量分数7.1%的KNO3溶液作为无土栽培的营养液,欲配制200g该营养液,需水g;KNO3在水中解离出的阳离子为(填符号);
②KCl和KNO3溶解度曲线如图2所示,30℃时,两物质各取25g,分别用100g水充分溶解,再把两溶液降温到10℃,析出的物质是 , 其析出的质量为 g.
(3)、水的保护:在日常生活中,软化硬水常用的方法是 , 防止水污染,人人有责,举一例生活中防止水污染的措施 .14.可用带柄V形玻璃管完成以下实验:
 (1)、如图1所示,往A处注入H2O2溶液,在B处下方加热使硫粉燃烧,产生的气体通入C处后排放的目的是 , 写出A处反应的化学方程式;(2)、如图2所示,A处盛浓氨水,B处放滴有无色酚酞试液的长滤纸条,可观察到的现象是 , 若另取一相同V形玻璃管(含相同的实验用品),在A处稍加热,在更短的时间内可观察到上述现象,请从微观角度解释 .15.
(1)、如图1所示,往A处注入H2O2溶液,在B处下方加热使硫粉燃烧,产生的气体通入C处后排放的目的是 , 写出A处反应的化学方程式;(2)、如图2所示,A处盛浓氨水,B处放滴有无色酚酞试液的长滤纸条,可观察到的现象是 , 若另取一相同V形玻璃管(含相同的实验用品),在A处稍加热,在更短的时间内可观察到上述现象,请从微观角度解释 .15.无机物甲、乙、丙经一步反应的转化关系如图所示,其中部分反应物、生成物及反应条件已略去.
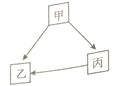 (1)、若反应皆为化合反应,且均在点燃条件下发生,则丙的化学式为;(2)、若反应皆为置换反应,且均在溶液中举行,甲、乙、丙都为金属,则它们的金属活动性由强到弱的顺序是(用“甲”、“乙”、“丙”表示);(3)、若反应皆为复分解反应,乙为白色难溶物.
(1)、若反应皆为化合反应,且均在点燃条件下发生,则丙的化学式为;(2)、若反应皆为置换反应,且均在溶液中举行,甲、乙、丙都为金属,则它们的金属活动性由强到弱的顺序是(用“甲”、“乙”、“丙”表示);(3)、若反应皆为复分解反应,乙为白色难溶物.①若甲为常见的酸,甲、乙、丙含相同的原子团,丙溶液为蓝色,则丙生成乙的化学方程式为(写一个);
②若甲为常见的碱,且相对分子质量为74,甲、乙、丙含相同的金属元素,丙溶液为无色,则丙生成乙的化学方程式为(写一个).
16. 用化学方法可制取纯净的物质,化学兴趣小组应用中和反应原理制取氯化钠固体.(1)、往装有氢氧化钠溶液的烧杯中滴入紫色石蕊试液,溶液呈色;(2)、如图,往该烧杯中继续逐滴滴加稀盐酸至溶液恰好变为紫色,再往反应后的溶液中加入活性炭,充分混合,过滤后得到无色滤液.

①加入活性炭的目的是;
②在过滤操作中,玻璃棒的作用是 .
(3)、用pH试纸测(2)中滤液的酸碱度,其操作方法:取pH试纸于玻璃片上, , 把试纸显示的颜色与标准比色卡比较,读出溶液的pH.(4)、若测得滤液pH为8,继续往滤液滴加稍过量的盐酸,目的是;蒸发该滤液以除去过量的盐酸,该操作利用的盐酸的性质是 , 继续蒸发滤液得到固体的过程中,用玻璃棒不断搅拌的目的是 .17. 化学兴趣小组在老师的帮助下围绕燃烧实验开展相关研究.(1)、探究一:氢气的燃烧实验

a.用锌和稀硫酸制取氢气,从图1中选择仪器组装一套随开随停的发生装置,所需仪器为(填编号);仪器B的名称是 .
b.按图2操作研究氢气的燃烧实验,需用试管收集不同体积比的氢气与空气的混合物,现用a中组装的正确装置制取氢气,如何用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,写出其操作方法: .
c.用不同体积比的混合气体做氢气的燃烧实验,结果如表:
序号
1
2
3
4
5
6
7
氢气与空气体积比
9:1
8:2
7:3
5:5
3:7
1:9
0.5:9.5
点燃现象
安静
燃烧
安静
燃烧
弱的
爆鸣声
强的
爆鸣声
强的
爆鸣声
弱的
爆鸣声
不燃烧
不爆鸣
分析上表信息,你对燃烧或燃烧条件的新认识是 .
(2)、探究二:可燃性粉尘燃烧剧烈程度的影响因素

a.用如图3装置研究某可燃性粉尘颗粒大小对燃烧剧烈程度的影响,燃烧剧烈程度用燃烧产生的最大压力衡量,容器内壁的传感器可测出燃烧产生的最大压力.
①实验过程中需改变的实验条件是 , 不能改变的是、、(仅列三种);
②实验测得可燃性粉尘颗粒大小与燃烧产生的最大压力的关系如图4所示,其原因是 .
b.兴趣小组另测得可燃性粉尘浓度与燃烧产生的最大压力的关系如图5所示,结合图5信息,提出防止可燃性粉尘发生燃烧的合理建议:①禁止烟火;② .
18. 以下是金属锡纯度的一种测定方法:步骤i 将样品全部溶于盐酸生成SnCl2溶液;
步骤ii 往所得SnCl2溶液加入过量的FeCl3溶液,发生反应:
SnCl2+2FeCl3═SnCl4+2FeCl2
步骤iii 用K2Cr2O7溶液测定步骤ii反应生成FeCl2的质量.
现有金属锡样品1.20g,经上述方法测得生成的FeCl2质量为2.54g(假设杂质不参加反应),计算并回答:
①样品溶于盐酸生成的SnCl2质量;
②样品中锡的质量分数(精确到0.01%)