高中化学鲁科版(2019)选择性必修2 第1章第3节 元素性质及其变化规律
试卷更新日期:2021-03-12 类型:同步测试
一、单选题
-
1. 下列原子的价电子排布中,对应元素第一电离能最大的是( )A、ns2np1 B、ns2np2 C、ns2np3 D、ns2np42. 下表列出了某短周期元素R的各级电离能数据(用I1、I2表示,单位为kJ·mol-1)
I1
I2
I3
I4
…
R
740
1500
7700
10500
…
下列关于元素R的判断中一定正确的是( )
A、R元素的原子最外层共有4个电子 B、R的最高正价为+3价 C、R元素位于元素周期表中第ⅡA族 D、R元素基态原子的电子排布式为1s22s23. 下列离子中,半径最大的是( )A、O2- B、S2- C、Mg2+ D、Cl-4. 下列各项叙述中,正确的是( )A、N、P、As的电负性随原子序数的增大而增大 B、价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 C、2p和3p轨道形状均为纺锤形,能量也相等 D、C、N、O的气态氢化物稳定性依次减弱5. 以下有关元素性质的说法不正确的是( )A、具有下列电子排布式的原子中:①1s22s22p63s23p2 , ②1s22s22p3 , ③1s22s22p2 , ④1s22s22p63s23p4 , 原子半径最大的是① B、具有下列价电子排布式的原子中:①3s23p1 , ②3s23p2 , ③3s23p3 , ④3s23p4 , 第一电离能最大的是③ C、①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ D、某元素气态基态离子的逐级电离能分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+6. 元素电负性随原子序数的递增而增强的是( )A、Si、P、Cl B、N、P、As C、O、S、Cl D、Li、Na、K7. 下列粒子半径之比大于1的是( )A、 B、 C、 D、8. 下列是几种原子的基态电子排布式,其中电负性最大的原子是( )A、1s22s22p4 B、1s22s22p63s23p3 C、1s22s22p63s23p2 D、1s22s22p63s23p64s29. 某元素X的逐级电离能如图所示,下列说法正确的是( )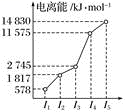 A、X元素可能为+4价 B、X可能为非金属 C、X为第五周期元素 D、X与氯反应时最可能生成的阳离子为X3+10. 现有三种元素的基态原子的电子排布式:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )A、第一电离能:③>②>① B、原子半径:③>②>① C、电负性:③>②>① D、最高正化合价:③>②>①
A、X元素可能为+4价 B、X可能为非金属 C、X为第五周期元素 D、X与氯反应时最可能生成的阳离子为X3+10. 现有三种元素的基态原子的电子排布式:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )A、第一电离能:③>②>① B、原子半径:③>②>① C、电负性:③>②>① D、最高正化合价:③>②>①二、填空题
-
11.
英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为 , 电负性由小到大的顺序为
 12.
12.(1)下列四种粒子中,半径按由大到小的排列顺序是 .
①基态X的原子结构示意图:

②基态Y的价电子排布式:3s23p5
③基态Z2﹣的电子排布图:

④W基态原子有2个能层,电子式:
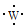
(2)已知An+、B(n+1)+、Cn﹣、D(n+1)﹣都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是 , 离子半径由大到小的顺序是
三、综合题
-
13. 已知元素的电负性、电离能和原子半径等内容一样,也是元素的一种基本性质,(1)、下面给出14种元素的电负性:
元素
Al
B
Be
C
Cl
F
Li
电负性
1.61
2.04
1.57
2.55
3.16
3.98
0.98
元素
Mg
N
Na
O
P
S
Si
电负性
1.31
3.04
0.93
3.44
2.19
2.58
1.90
试结合元素周期律知识完成下列问题:
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐 , 同主族元素从上至下,电负性逐渐 .
②预测元素电负性的大小关系:BrI,电负性最小的元素在周期表中的位置是(放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是 .
(2)、如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所 需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力②形成稳定结构的倾向.下表是一些气态原子失去核外不同电子所需的能量:锂
X
Y
失去第1个电子
519
502
580
失去第2个电子
7296
4570
1820
失去第3个电子
11799
6920
2750
失去第4个电子
9550
11600
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量 .
②表中X Y为第3周期元素,则X为 , Y为 . 第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是(均填元素符号).