高中化学鲁科版(2019)选择性必修2 第1章第2节 原子结构与元素周期表
试卷更新日期:2021-03-12 类型:同步测试
一、单选题
-
1. 下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )
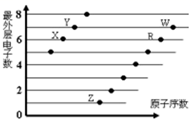 A、元素非金属性:X>R>W B、X与R形成的分子内含两种作用力 C、元素对应的离子半径:W>R>Y D、X、Z形成的化合物中可能含有共价键2. 某主族元素的原子最外层电子排布是 5s1 , 该元素或其化合物不可能具有的性质是( )A、该元素的氧化物的水合物显碱性 B、其原子半径比钾原子半径大 C、其碳酸盐易溶于水 D、该元素单质常温下跟水反应不如钠剧烈3. 现有四种元素的基态原子的电子排布式:
A、元素非金属性:X>R>W B、X与R形成的分子内含两种作用力 C、元素对应的离子半径:W>R>Y D、X、Z形成的化合物中可能含有共价键2. 某主族元素的原子最外层电子排布是 5s1 , 该元素或其化合物不可能具有的性质是( )A、该元素的氧化物的水合物显碱性 B、其原子半径比钾原子半径大 C、其碳酸盐易溶于水 D、该元素单质常温下跟水反应不如钠剧烈3. 现有四种元素的基态原子的电子排布式:① ;② ;③ ;④ 。
则下列有关比较中正确的是( )
A、第一电离能:④>③>②>① B、原子半径:④>③>②>① C、电负性:④>③>②>① D、最高正化合价:④>③=②>①4. 4p能级只填充一半电子的原子,其原子序数是( )A、15 B、33 C、35 D、515. 下列关于化学用语的表示错误的是( )A、Na+的轨道表示式: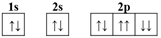 B、氯离子的结构示意图:
B、氯离子的结构示意图:  C、原子核内有8个中子的氧原子:
D、硫离子的核外电子排布式:1s22s22p63s23p6
6. 下列表达方式错误的是( )A、四氯化碳的电子式:
C、原子核内有8个中子的氧原子:
D、硫离子的核外电子排布式:1s22s22p63s23p6
6. 下列表达方式错误的是( )A、四氯化碳的电子式: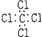 B、氟化钠的电子式:
B、氟化钠的电子式:  C、硫离子的核外电子排布式:1s22s22p63s23p6
D、碳-12原子:
7. 下列说法正确的是:( )A、3p2表示3p能级有两个轨道 B、同一原子中,1s、2s、3s电子的能量逐渐减小 C、每个周期中最后一种元素的第一电离能最大 D、短周期中,电负性(稀有气体未计)最大的元素是Na8. 下列说法正确的是( )A、原子核外各电子层最多能容纳的电子数为 n2 B、同一主族中,第三周期和第四周期元素原子的核电荷数都相差 8 C、门捷列夫在 1869 年提出了元素的性质随着原子序数的递增而呈现周期性变化的规律 D、位于第四周期第ⅣA 族的元素为金属元素9. 下列叙述中,正确的是( )A、在多电子的原子里,能量高的电子通常在离核近的区域内活动 B、微粒的最外层只能是8个电子才稳定 C、两种微粒,若核外电子排布完全相同,则其化学性质一定相同 D、核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层10. 元素 、 、 在周期表中的相对位置如图所示。已知 元素原子的外围电子排布式为 ,则下列说法错误的是( )
C、硫离子的核外电子排布式:1s22s22p63s23p6
D、碳-12原子:
7. 下列说法正确的是:( )A、3p2表示3p能级有两个轨道 B、同一原子中,1s、2s、3s电子的能量逐渐减小 C、每个周期中最后一种元素的第一电离能最大 D、短周期中,电负性(稀有气体未计)最大的元素是Na8. 下列说法正确的是( )A、原子核外各电子层最多能容纳的电子数为 n2 B、同一主族中,第三周期和第四周期元素原子的核电荷数都相差 8 C、门捷列夫在 1869 年提出了元素的性质随着原子序数的递增而呈现周期性变化的规律 D、位于第四周期第ⅣA 族的元素为金属元素9. 下列叙述中,正确的是( )A、在多电子的原子里,能量高的电子通常在离核近的区域内活动 B、微粒的最外层只能是8个电子才稳定 C、两种微粒,若核外电子排布完全相同,则其化学性质一定相同 D、核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层10. 元素 、 、 在周期表中的相对位置如图所示。已知 元素原子的外围电子排布式为 ,则下列说法错误的是( ) A、 元素原子的价电子排布式为 B、 元素在元素周期表的第三周期第ⅥA族 C、 元素所在周期中所含非金属元素最多 D、 元素原子的核外电子排布式为
A、 元素原子的价电子排布式为 B、 元素在元素周期表的第三周期第ⅥA族 C、 元素所在周期中所含非金属元素最多 D、 元素原子的核外电子排布式为二、综合题
-
11. 根据元素周期表中完整周期元素的性质,在下列空格中填上适当的元素符号。(1)、在第三周期中,第一电离能最小的元素是 , 第一电离能最大的元素是。(2)、在元素周期表中,电负性最大的元素是(3)、第二周期,原子最外电子层中p能级半充满的元素是。12. 有A,B,C,D四种元素,其原子序数依次增大,且质子数均小于18。A元素原子的最外层只有1个电子,该元素阳离子与N3-核外电子排布相同;B元素原子核外各轨道上均无成单电子;C元素原子的价电子排布为ns2np2;D-的核外电子构型与Ar相同。(1)、写出A,C,D的元素符号:A , C , D。(2)、写出B元素电子的电子排布式;D元素电子的电子排布图。13. 周期表前四周期的元素 、 、 、 ,原子序数依次增大,X原子核外有 6 种不同运动状态的电子; 原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料; 位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:(1)、X位于周期表的第周期,第族。(2)、元素的第一电离能:XY(填“>”或“<”,下同);原子半径:XY。(3)、 的最高价氧化物对应水化物中酸根离子的空间构型(用文字描述)。(4)、 基态核外电子排布式为 , 用硫氰化钾溶液检验 的离子方程式为。14.(1)、I.N和Li、Na形成的Li3N、NaN3等化合物具有重要的用途。完成下列填空:
氮原子核外能量最高的电子所处的轨道是:。锂离子核外电子的轨道表示式是:。
(2)、已知Li3N熔点为845℃,NH3熔点﹣77.7℃,用物质结构的知识说明这两种含氮化合物熔点差异的可能原因。(3)、II.研究者发明了利用锂循环合成氨的工艺,其流程如下: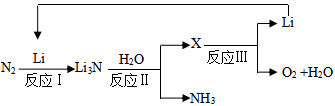
每合成1mol氨,转移电子mol;该过程最终得到的氧化产物是。
(4)、写出反应Ⅱ的化学反应方程式:。向0.35gLi3N中加入40mL1mol/L的盐酸,所得溶液中离子浓度由大到小的顺序是:。(5)、由元素周期律能得到____________(填序号)。A、碱性:LiOH<NaOH B、与水反应的剧烈程度:Li<Na C、溶解度:LiOH<NaOH D、密度:Li<Na(6)、NaN3可用于汽车安全气囊,冲撞时发生如下反应:□NaN3+□KNO3→□K2O+□Na2O+□N2↑,配平此反应的化学方程式,并标出电子转移的数目和方向。