高中化学鲁科版(2019)必修第二册 第1章测试卷
试卷更新日期:2021-03-12 类型:单元试卷
一、单选题
-
1. 古代中国常用如图所示装置来炼丹、熬烧酒、制花露水等》,南宋张世南《游宦纪闻》中记载了民间制取花露水的方法:“锡为小甑,实花一重,香骨一重,常使花多于香,转甑之傍,以泄汗液,以器贮之。”该装置利用的实验操作方法是( )
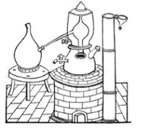 A、升华 B、过滤 C、萃取 D、蒸馏2. 焰火与高中化学中“焰色试验”知识有关。下列有关“焰色试验”说法中正确的是( )A、烟花呈现的艳丽色彩是由锂、钠、钾、锶、钡等金属单质的燃烧呈现出来的 B、做焰色反应实验只能用铂丝蘸取溶液在外焰上灼烧 C、碳酸钾在酒精灯上灼烧时能直接观察到紫色火焰 D、NaCl与Na2SO4灼烧时火焰颜色均为黄色3. 萃取溴水中的溴单质,能用作萃取剂的是( )A、氢氧化钠溶液 B、酒精 C、四氯化碳 D、乙酸4. 已知元素R有某种同位素的氯化物RClX , 该氯化物中R微粒核内中子数为Y,核外电子数为Z,该同位素的符号为 ( )A、 B、 C、 D、5. 下列各组中互为同位素的是( )A、甲烷和乙烷 B、O2和O3 C、正丁烷和异丁烷 D、 和6. 下列叙述中,正确的是( )A、两种粒子,若核外电子排布相同,则其化学性质一定相同 B、凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 C、两原子如果核外电子排布相同,则一定属于同种元素 D、阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同7. 某元素原子 的质量数为A,中子数为N,它的阴离子与1H+组成HmX-离子,则agHmX-中所含质子的物质的量是( )A、 B、 C、 D、8. 科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )
A、升华 B、过滤 C、萃取 D、蒸馏2. 焰火与高中化学中“焰色试验”知识有关。下列有关“焰色试验”说法中正确的是( )A、烟花呈现的艳丽色彩是由锂、钠、钾、锶、钡等金属单质的燃烧呈现出来的 B、做焰色反应实验只能用铂丝蘸取溶液在外焰上灼烧 C、碳酸钾在酒精灯上灼烧时能直接观察到紫色火焰 D、NaCl与Na2SO4灼烧时火焰颜色均为黄色3. 萃取溴水中的溴单质,能用作萃取剂的是( )A、氢氧化钠溶液 B、酒精 C、四氯化碳 D、乙酸4. 已知元素R有某种同位素的氯化物RClX , 该氯化物中R微粒核内中子数为Y,核外电子数为Z,该同位素的符号为 ( )A、 B、 C、 D、5. 下列各组中互为同位素的是( )A、甲烷和乙烷 B、O2和O3 C、正丁烷和异丁烷 D、 和6. 下列叙述中,正确的是( )A、两种粒子,若核外电子排布相同,则其化学性质一定相同 B、凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 C、两原子如果核外电子排布相同,则一定属于同种元素 D、阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同7. 某元素原子 的质量数为A,中子数为N,它的阴离子与1H+组成HmX-离子,则agHmX-中所含质子的物质的量是( )A、 B、 C、 D、8. 科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )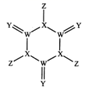 A、原子半径:Z>Y>X>W B、氢化物的稳定性:W>X>Y C、X的氧化物的水化物是强酸 D、Y的某种单质具有杀菌消毒作用9. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有2个未成对电子,Y是地壳中含量最高的元素,常温下0.01 mol·L-1 Z的最高价氧化物对应的水化物溶液的pH=12,W在元素周期表中的族序数是周期数的2倍。下列说法正确的是( )A、工业上常用电解法冶炼Z单质 B、原子半径:r (Z)>r (W)>r(Y)>r(X) C、X简单气体氢化物的稳定性比Y的强 D、W的最高价氧化物对应的水化物的酸性比Y强10. 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
A、原子半径:Z>Y>X>W B、氢化物的稳定性:W>X>Y C、X的氧化物的水化物是强酸 D、Y的某种单质具有杀菌消毒作用9. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有2个未成对电子,Y是地壳中含量最高的元素,常温下0.01 mol·L-1 Z的最高价氧化物对应的水化物溶液的pH=12,W在元素周期表中的族序数是周期数的2倍。下列说法正确的是( )A、工业上常用电解法冶炼Z单质 B、原子半径:r (Z)>r (W)>r(Y)>r(X) C、X简单气体氢化物的稳定性比Y的强 D、W的最高价氧化物对应的水化物的酸性比Y强10. 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )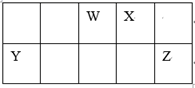 A、氢化物沸点:X<Z B、最高价氧化物对应水化物的酸性:Y>W C、化合物熔点: D、简单离子的半径:Y<X11. W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为3:8;X与W同主族;Y的原子系数是W和X的原子系数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )A、原子半径:Y>Z B、简单氢化物的沸点:X>W C、离子的还原性:X>W D、Y、Z的最高价氧化物对应的水化物的碱性:Y>Z12. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
A、氢化物沸点:X<Z B、最高价氧化物对应水化物的酸性:Y>W C、化合物熔点: D、简单离子的半径:Y<X11. W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为3:8;X与W同主族;Y的原子系数是W和X的原子系数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )A、原子半径:Y>Z B、简单氢化物的沸点:X>W C、离子的还原性:X>W D、Y、Z的最高价氧化物对应的水化物的碱性:Y>Z12. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )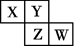 A、Y和Z的最高正化合价相同 B、气态氢化物的热稳定性:XH3<H2Y<H2Z C、原子半径的大小:r(W)>r(Y)>r(Z) D、W的最高价氧化物对应水化物的酸性比Z的强13. 现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是( )
A、Y和Z的最高正化合价相同 B、气态氢化物的热稳定性:XH3<H2Y<H2Z C、原子半径的大小:r(W)>r(Y)>r(Z) D、W的最高价氧化物对应水化物的酸性比Z的强13. 现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是( )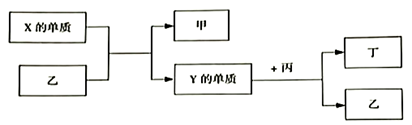 A、原子半径由小到大的顺序是:W<Z<Y<X B、Z的最高价氧化物对应的水化物一定为强酸 C、化合物的沸点由高到低的顺序是:乙>甲>丙 D、Y与W、Z都只能形成两种化合物14. 根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
A、原子半径由小到大的顺序是:W<Z<Y<X B、Z的最高价氧化物对应的水化物一定为强酸 C、化合物的沸点由高到低的顺序是:乙>甲>丙 D、Y与W、Z都只能形成两种化合物14. 根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )选项
事实
推测
A
CaCO3和BaCO3都难溶于水
SrCO3也难溶于水
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1 500 ℃时分解,HI在230 ℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A、A B、B C、C D、D15. 从含有KI、KNO3等成分的废水中回收I2和KNO3 , 其流程如图所示,下列说法错误的是( )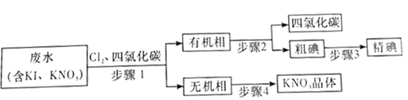 A、步骤1中有机相应从分液漏斗的下口放出,无机相从上口倒出 B、步骤2可采用减压蒸馏的方法分离四氯化碳和碘 C、步骤3可利用碘易升华的性质提纯粗碘 D、步骤4将溶液蒸发至大量晶体析出时,再用余热蒸干
A、步骤1中有机相应从分液漏斗的下口放出,无机相从上口倒出 B、步骤2可采用减压蒸馏的方法分离四氯化碳和碘 C、步骤3可利用碘易升华的性质提纯粗碘 D、步骤4将溶液蒸发至大量晶体析出时,再用余热蒸干二、综合题
-
16. 下表是元素周期表的一部分,表中的每个序号代表一种短周期元素。
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
①
2
②
③
④
3
⑤
⑥
⑦
⑧
(1)、元素①和②可以组成最简单的有机物,其化学式为。(2)、元素③的最高价氧化物对应的水化物的化学式为。(3)、元素④和⑤可组成原子个数比为1∶1的化合物,化学式为。(4)、在元素⑦和⑧的原子分别形成的简单阴离子中,离子半径较大的是(填离子符号)。17. 短周期元素X、Y、Z、W、N 的原子序数依次增大,其中X 的一种同位素原子没有中子,Y 的一种核素可做考古学家测定文物的年代,Z 为地壳中含量最多的非金属元素,W 的焰色反应为黄色,N 原子为所在周期原子半径最小的原子(稀有气体除外)(1)、W 在周期表中的位置 ;X、Z 形成的原子个数比 1:1 的分子的结构式 。(2)、元素 Z 和 W 形成的一种化合物为淡黄色固体,该化合物的电子式为 , 该化合物中化学键有 , 该化合物与 Y 的最高价氧化物反应的化学方程式为 。(3)、Z、W、N 的简单离子半径从大到小的顺序: (用离子符号表示)(4)、甲和乙是由上述元素 X 分别与元素 Y、Z 形成的 10 电子分子,沸点>(填化学式),原因:。18. 下表是元素周期表的一部分,表中的每个字母代表一种短周期元素。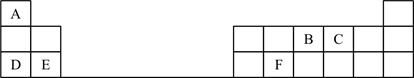
请填写下列空白:
(1)、A与B形成BA3的电子式为;C的原子结构示意图为。(2)、B的最高价氧化物对应的水化物的化学式为;D、E的最高价氧化物对应的水化物中碱性较弱的是(用化学式表示);(3)、F的氧化物与氢氧化钠溶液反应的离子方程式为。19. 化合物X由三种元素(其中一种是第四周期元素)组成,现进行如下实验: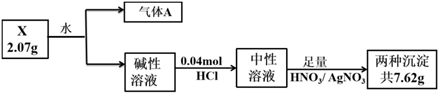
已知:气体A在标准状况下密度为0.714 g·L-1;碱性溶液焰色反应呈黄色。
(1)、X中非金属元素的名称为 , X的化学式。(2)、X与水反应的化学方程式为。(3)、化合物Y由X中金属元素和第四周期元素构成,设计实验证明Y的晶体类型。(4)、补充焰色反应的操作:取一根铂丝, , 蘸取待测液灼烧,观察火焰颜色。20. 化学在金属矿物和海水资源的开发利用过程中具有重要的意义和作用。按要求回答下列问题。(1)、在工业生产中金属冶炼的原理错误的是_A 电解熔融的 NaCl 来制取 Na
B 电解熔融的 AlCl3 来制取 Al
C CO 还原 Fe2O3 制取 Fe
D 铝热反应原理制锰:4Al+3MnO2 3Mn+2 Al2O3
(2)、下图是从海水中提取溴的简单流程: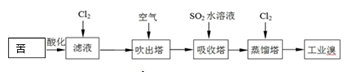
提取溴的过程中,经过 2 次 Br- Br2 转化的目的是
(3)、吸收塔中发生反应的离子方程式是(4)、海带中富含碘元素,实验室从海带中提取 I2 的途径如下图所示: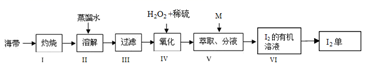
①步骤 I 灼烧海带至灰烬时所用的主要仪器名称是 。
②步骤 IV 向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式 。
③步骤 V 加入萃取剂 M 为 , 步骤 VI 从 I2 的有机溶液获得 I2 可以用 的方法。