高中化学鲁科版(2019)必修第二册 第1章 微项目 海带提碘与海水提溴
试卷更新日期:2021-03-12 类型:同步测试
一、单选题
-
1. 下列叙述正确的是( )A、关于碱金属单质,它们都是电和热的良导体,均为银白色 B、H2、D2、T2互为同位素 C、碱金属单质都可以保存在煤油中,碱金属单质在空气中加热均可生成多种氧化物 D、F2 、Cl2、Br2 、I2单质的颜色随核电荷数的增加而加深2. 下列物质分离操作错误的是( )A、分离豆腐花和豆浆水:过滤 B、提取白酒中的乙醇:分液 C、除去NaCl溶液中少量KNO3:蒸发结晶,趁热过滤 D、利用海水制取蒸馏水:蒸馏3. 某加碘食盐包装袋上标有“忌高温蒸炒”,由此判断下列说法中正确的是( )A、此食盐是纯净物 B、食盐中加入了碘单质 C、所加含碘物质受热易分解 D、加碘食盐难溶于水4. 利用海水提取溴和镁的过程如下,下列说法错误的是( )
 A、工业溴中含少量Cl2 , 可用NaOH溶液除去 B、工业上常利用电解熔融MgCl2冶炼金属镁 C、富集溴元素过程中,空气吹出法利用了溴易挥发的性质 D、若提取1 mol Br2 , 至少需要标准状况下44.8 L的Cl25. 下列实验中,所采取的分离方法与对应原理都正确的是( )
A、工业溴中含少量Cl2 , 可用NaOH溶液除去 B、工业上常利用电解熔融MgCl2冶炼金属镁 C、富集溴元素过程中,空气吹出法利用了溴易挥发的性质 D、若提取1 mol Br2 , 至少需要标准状况下44.8 L的Cl25. 下列实验中,所采取的分离方法与对应原理都正确的是( )选项
目的
分离方法
原理
A
分离溶于水的碘
乙醇萃取
碘在乙醇中的溶解度较大
B
分离水和乙醇
分液
水和乙醇的密度不同
C
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D
除去丁醇(沸点为117.5 ℃)中的乙醚(沸点为34.6 ℃)
蒸馏
丁醇与乙醚的沸点相差较大
A、A B、B C、C D、D6. 为了从海带浸取液中提取碘,某同学设计了如下实验方案: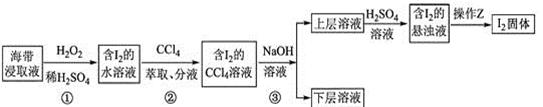
下列说法正确的是( )
A、①中反应的离子方程式:2I− + H2O2=I2 + 2OH− B、②中分液时含I2的CCl4溶液从分液漏斗上口倒出 C、③中得到的上层溶液中含有I− D、操作Z的名称是加热7. 溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。提取碘的途径如下图所示,下列有关叙述错误的是( )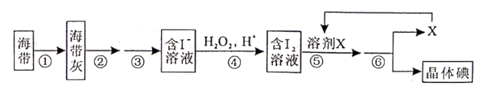 A、操作①在坩埚中进行 B、操作②③中所用到的玻璃仪器有:玻璃棒、烧杯、漏斗 C、每消耗1molH2O2转移电子数为2NA D、溶剂X可选用酒精或苯8. 碘在自然界中有很多存在形式,在地壳中主要以 形式存在,在海水中主要以 形式存在,几种粒子与 之间有以下转化关系:
A、操作①在坩埚中进行 B、操作②③中所用到的玻璃仪器有:玻璃棒、烧杯、漏斗 C、每消耗1molH2O2转移电子数为2NA D、溶剂X可选用酒精或苯8. 碘在自然界中有很多存在形式,在地壳中主要以 形式存在,在海水中主要以 形式存在,几种粒子与 之间有以下转化关系:
以下说法错误的是( )
A、①中发生的反应是置换反应 B、 与过量 发生的反应是 C、以上反应中,氯气都体现氧化性,具体表现为氯元素由0价降低为-1价 D、通过以上信息,可预测:若在加入淀粉的 溶液中逐滴滴加氯水,不能观察到溶液变蓝的现象9. 某溶液中含有的溶质是FeBr2、FeI2 , 若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色 已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀 ,则下列叙述正确的是( )A、原溶液中的Br-一定被氧化 B、通入氯气之后原溶液中的Fe2+一定被氧化 C、溶液中一定不存在Fe2+ D、若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,能产生黄色沉淀10. 某小组比较Cl-、Br-、I- 的还原性,实验如下:实验1
实验2
实验3
装置
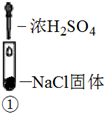
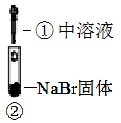
现象
溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟
溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝
溶液变深紫色;经检验溶液含单质碘
下列对实验的分析不合理的是( )
A、实验1中,白烟是NH4Cl B、根据实验1和实验2判断还原性:Br->Cl- C、根据实验3判断还原性:I->Br- D、上述实验利用了浓H2SO4的强氧化性、难挥发性等性质二、综合题
-
11. 如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
 (1)、从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母, 下同);除去自来水中的Cl- 等杂质,选择装置。(2)、从碘水中分离出I2 , 选择装置,该分离方法的名称为。(3)、装置A中①的名称是 , 进水的方向是从 口进水. 装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是。(4)、海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
(1)、从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母, 下同);除去自来水中的Cl- 等杂质,选择装置。(2)、从碘水中分离出I2 , 选择装置,该分离方法的名称为。(3)、装置A中①的名称是 , 进水的方向是从 口进水. 装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是。(4)、海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤
有:
①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;
④调节溶液的pH等于7;⑤溶解:⑥过滤;⑦蒸发.
正确的操作顺序是 (填选项字母).
a.⑤②③①⑥④⑦ b. ⑤①②③⑥④⑦
c. ⑤②①③④⑥⑦ d. ⑤③②①⑥④⑦
12. 海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图: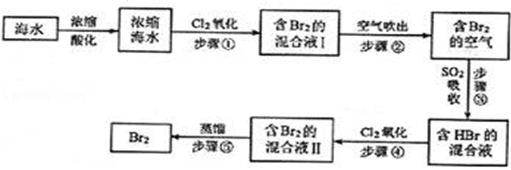
请回答下列问题.
(1)、将海水浓缩的方法是;(2)、步骤①反应的离子方程式是 , 1molCl2参加反应,转移电子mol;(3)、步骤②通入热空气吹出Br2 , 利用了Br2的______(填序号);A、氧化性 B、还原性 C、挥发性 D、腐蚀性(4)、步骤③中用SO2的水溶液吸收Br2 , 吸收率可达95%,该反应的氧化剂是 , 在工业生产中此步骤应解决的问题是.13. 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:(1)、已知碘元素最终变为无色HIO3。上述整个过程中的还原剂是。写出CCl4层变成紫色的离子反应方程式。(2)、若把KI换成KBr,则CCl4层变为色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。(3)、智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。试配平该反应的化学方程式,并用短线标出电子转移方向及总数NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+( )H2O,已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO42-离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:。