高中化学鲁科版(2019)必修第二册 第1章第3节 元素周期表的应用
试卷更新日期:2021-03-12 类型:同步测试
一、单选题
-
1. X、Y、Z、W 为原子序数依次增大的短周期主族元素. 它们能形成离子化合物 A([YX4]+[ZW4]-).Y 元素的最高正价和最低负价代数和为2,Z单质在常温下能被浓硫酸钝化. 下列说法错误的是( )A、W 元素位于第三周期ⅦA 族 B、氧化物的水化物的酸性:W<Y C、原子半径:Y<Z D、A 能与强碱反应生成有刺激性气味的气体2. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子序数是Z的原子序数的一半,W、X、Y三种元素形成的化合物M结构如图所示。下列叙述正确的是( )
 A、原子半径:Z>X>W B、气态氢化物的稳定性:Z>W>Y C、Y的最高价氧化物的水化物可溶于X和Z的最高价氧化物的水化物 D、化合物M中所有的原子均满足8电子稳定结构3. 已知X、Y、Z、W均为短周期元素。25℃时, 其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法错误的是( )
A、原子半径:Z>X>W B、气态氢化物的稳定性:Z>W>Y C、Y的最高价氧化物的水化物可溶于X和Z的最高价氧化物的水化物 D、化合物M中所有的原子均满足8电子稳定结构3. 已知X、Y、Z、W均为短周期元素。25℃时, 其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法错误的是( ) A、Z元素最高价氧化物的化学式为ZO3 B、简单离子半径大小顺序:X>M C、气态氢化物的稳定性:Z>W D、X、Z的最简单气态氢化物反应有白烟生成4. 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是( )
A、Z元素最高价氧化物的化学式为ZO3 B、简单离子半径大小顺序:X>M C、气态氢化物的稳定性:Z>W D、X、Z的最简单气态氢化物反应有白烟生成4. 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是( ) A、阴离子的还原性:Y>W B、W、Y、Z元素的简单离子半径由大到小顺序为Z>Y>W C、W2Y2中含有非极性键 D、Y与W形成的简单化合物是同主族元素同类型化合物中沸点最低的5. 短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素.Y的原子最外层电子数是其电子层数的3倍,W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是( )A、非金属性:Q>Y>X>Z B、简单气态氢化物的沸点:X>W C、Y与X、Z、Q均可形成至少两种二元化合物 D、Y、Z、Q组成化合物的水溶液呈碱性6. X、Y、Z、Q、R是原子序数依次递增的短周期元素,其中Z元素与R元素同主族,Y、Z、Q元素的原子最外层电子数之和等于R元素的原子序数,化合物X2Q常温下呈液态。下列说法错误的是( )A、原子半径:Q<Z<R B、最高价氧化物对应水化物的酸性:Z>R>Y C、由X、Y、Z、Q四种元素可以组成化学式为Y2X7ZQ2的离子化合物 D、由这五种元素中的一种或多种元素的原子构成的含14个电子的分子只有2种7. 已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中错误的是( )
A、阴离子的还原性:Y>W B、W、Y、Z元素的简单离子半径由大到小顺序为Z>Y>W C、W2Y2中含有非极性键 D、Y与W形成的简单化合物是同主族元素同类型化合物中沸点最低的5. 短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素.Y的原子最外层电子数是其电子层数的3倍,W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是( )A、非金属性:Q>Y>X>Z B、简单气态氢化物的沸点:X>W C、Y与X、Z、Q均可形成至少两种二元化合物 D、Y、Z、Q组成化合物的水溶液呈碱性6. X、Y、Z、Q、R是原子序数依次递增的短周期元素,其中Z元素与R元素同主族,Y、Z、Q元素的原子最外层电子数之和等于R元素的原子序数,化合物X2Q常温下呈液态。下列说法错误的是( )A、原子半径:Q<Z<R B、最高价氧化物对应水化物的酸性:Z>R>Y C、由X、Y、Z、Q四种元素可以组成化学式为Y2X7ZQ2的离子化合物 D、由这五种元素中的一种或多种元素的原子构成的含14个电子的分子只有2种7. 已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中错误的是( )元素性质
元素编号
①
②
③
④
⑤
⑥
⑦
原子半径(nm)
0.073
0.075
0.037
0.110
0.099
0.186
0.143
最高正化合价
无
+5
+1
+5
+7
+1
+3
最低负化合价
-2
-3
-1
-3
-1
无
无
A、⑦的简单离子是同周期元素离子半径最小的 B、②的气态氢化物浓溶液可用于检验氯气管道的泄漏 C、气态氢化物的稳定性①﹤② D、最高价氧化物的水化物的酸性④﹤⑤8. 短周期元素X、Y、Z、W的原子序数依次增大,Y与W同族,W的核电荷数是Y的两倍,四种元素组成的一种化合物如图所示。下列说法一定正确的是( ) A、简单离子半径:Z>W>Y>X B、最简单氢化物的稳定性:W>Y C、X与Z可形成离子化合物ZX D、W的氧化物对应的水化物为强酸
A、简单离子半径:Z>W>Y>X B、最简单氢化物的稳定性:W>Y C、X与Z可形成离子化合物ZX D、W的氧化物对应的水化物为强酸二、综合题
-
9. 下表为元素周期表的前三周期。

回答下列问题:
(1)、写出元素符号⑤ , ⑦。(2)、表中所列元素中,金属性最强的元素是(填元素符号,下同),非金属性最强的元素是;最高价氧化物对应水化物中,酸性最强的是(填化学式)。(3)、①、②、③三种元素的原子半径最大的是(填元素符号);④号元素与⑧号元素形成化合物的电子式为。10. 现有8种短周期元素的性质,数据如下表所列:①
②
③
④
⑤
⑥
⑦
⑧
原子半径(10-10m)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高或最低化合价
+2
+1
+5
+7
+1
+5
+3
-2
-3
-1
-3
回答下列问题:
(1)、③的元素符号是 , ⑧的元素名称是。①在元素周期表中的位置是 (周期、族)。(2)、在这8种元素中,最高价氧化物对应的水化物中,酸性最强的化合物其分子式是;碱性最强的化合物电子式是;属化合物(填“离子”或“共价”)。(3)、比较④和⑦的氢化物的稳定性 (用化学式表示)。(4)、写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:。(5)、写出②的最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:。11. 硅在地壳中的含量较高,硅及其化合物的开发由来已久。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: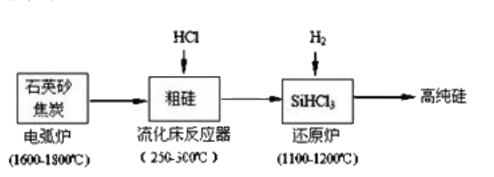 (1)、工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为。(2)、在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_。(3)、有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_;
(1)、工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为。(2)、在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_。(3)、有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_;SiHCl3极易水解且生成某种可燃性气体,其完全水解的产物为_。
物质
Si
SiCl4
SiHCl3
SiH2Cl2
SiH3Cl
HCl
SiH4
熔点/℃
1410
-70.4
-126.5
-122
-118
-114.2
-185
沸点/℃
2355
57.6
31.8
8.2
-30.4
-84.9
-111.9
(4)、还原炉中发生的化学反应为: 。.(5)、上述工艺生产中循环使用的物质除Si、SiHCl3外, 还有_。三、推断题
-
12. X、Y、Z、W均为短周期主族元素,X、Y、Z原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。W的最外层电子数等于X的核外电子总数,且W单质常温下为固体。请回答下列问题:(1)、Z在周期表中的位置为。(2)、Y元素形成的离子的结构示意图为。(3)、X、Y、Z三种元素对应的原子半径大小关系为(填元素符号)。(4)、X和Z形成的简单氢化物,热稳定性较好的是(填化学式)。(5)、下列说法正确的是_______。A、X的氢化物在常温常压下均为气体 B、最高价氧化物对应的水化物的酸性W>Z C、由于Z的氧化物ZO2既可与酸反应,又能与碱反应,所以ZO2为两性氧化物 D、W的氧化物WO2 , 具有还原性,能使酸性KMnO4溶液褪色13. 有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体;
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体;
④G是除氢外原子半径最小的元素。
(1)、A的名称是 , B位于周期表中第周期第族。(2)、E单质的颜色是。(3)、A元素与D元素形成化合物的电子式是。(4)、G的单质与水反应的化学方程式是。(5)、F的元素符号是。(6)、在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 , 酸性最强的化学式是 , 气态氢化物最稳定的化学式是。(7)、将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是。