高中化学鲁科版(2019)必修第二册 第1章第2节 元素周期律和元素周期表
试卷更新日期:2021-03-12 类型:同步测试
一、单选题
-
1. 迄今为止,人类发现和合成的有机化合物已超过了7000万种。有机物一定含有碳元素,碳元素在元素周期表中处于( )A、第一周期 B、第二周期 C、ⅥA族 D、Ⅳ族2. 联合国宣布2019年为“国际化学元素周期表年”。元素W、X、Y和Z在周期表中的相对位置如图所示,其中元素Z位于第四周期,W、X、Y原子的最外层电子数之和为 18。下列说法正确的是( )
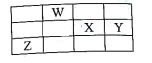 A、简单氢化物沸点:Y>W B、原子半径:Z>Y>X C、氧化物的水化物的酸性:W<X D、推测Z是半导体材料,Z与Y可形成化合物ZY43. 下列对焰色试验操作注意事项的说明,正确的是( )
A、简单氢化物沸点:Y>W B、原子半径:Z>Y>X C、氧化物的水化物的酸性:W<X D、推测Z是半导体材料,Z与Y可形成化合物ZY43. 下列对焰色试验操作注意事项的说明,正确的是( )①钾的火焰颜色,要透过蓝色钴玻璃观察
②先把铂丝灼烧到与原来火焰颜色相同,再蘸取被检验的物质
③每次试验后,要用盐酸把铂丝洗净
④试验时最好选择本身颜色较微弱的火焰
⑤没有铂丝,也可用光洁无锈的铁丝代替
A、②④⑤ B、②③⑤ C、①③④ D、①②③④⑤4. 下表为元素周期表的一部分。下列事实不能说明X元素、Y元素、S元素之间的非金属性强弱关系的是( ) A、X2单质与H2S溶液反应,溶液变浑浊 B、H2X和H2S分别受热分解,前者的分解温度高 C、酸性:HYO4>H2SO4 D、Na2SO3可与HY反应生成H2SO35. 下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )
A、X2单质与H2S溶液反应,溶液变浑浊 B、H2X和H2S分别受热分解,前者的分解温度高 C、酸性:HYO4>H2SO4 D、Na2SO3可与HY反应生成H2SO35. 下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )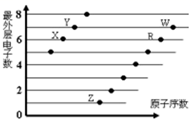 A、元素非金属性:X>R>W B、X与R形成的分子内含两种作用力 C、元素对应的离子半径:W>R>Y D、X、Z形成的化合物中可能含有共价键6. ①~⑧均为短周期元素,根据表中数据判断下列说法错误的是( )
A、元素非金属性:X>R>W B、X与R形成的分子内含两种作用力 C、元素对应的离子半径:W>R>Y D、X、Z形成的化合物中可能含有共价键6. ①~⑧均为短周期元素,根据表中数据判断下列说法错误的是( )
①
②
③
④
⑤
⑥
⑦
⑧
原子半径(10-10)m
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.89
主要化合价
最高价
+2
+1
+5
+7
+1
+5
+2
最低价
-2
-3
-1
-3
A、③和⑥、④和⑦分别处于同一主族 B、元素④处于第3周期VA族 C、元素⑥对应的氢氧化物是强碱 D、元素①与元素⑥形成的化合物中不可能存在共价键7. 下列各组元素属于p区的是( )A、原子序数为1、2、7的元素 B、S、O、P C、Fe、Ar、Cl D、Na、Li、Mg8. 下列有关元素周期表的说法错误的是( )A、第1列元素种类最多 B、第2列元素中肯定没有非金属元素 C、第15列某元素能与其他元素化合形成碱性气体 D、第17列的第一种元素的原子序数为99. 具有下列特征的元素,一定是短周期主族元素的是( )A、原子序数为20 B、最外层只有2个电子 C、元素原子的质子数为26 D、最外层有3个电子的非金属元素10. X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )A、已知mXa+与nYb- , 得m+a=n-b B、离子半径:Yb->Z(b+1)->Xa+ C、Z(b+1)-的还原性一定大于Yb- D、气态氢化物的稳定性Hb+1Z一定大于HbY11. 已知 为第Ⅱ 族元素, 为第Ⅲ 族元素,它们的原子序数分别为 和 ,且 为同一周期元素,则下列关系错误的是:( )A、 B、 C、 D、12. 下列金属性质的比较中,能说明甲的金属性比乙强的是:( )①甲与水反应比乙与水反应剧烈
②单质甲能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强
④以甲、乙金属为电极构成原电池,甲作负极
A、①④ B、③④ C、①②③④ D、①②③二、综合题
-
13. 元素周期表是学习化学的重要工具,如图为元素周期表中部分元素的相关信息,利用如图回答相关问题。
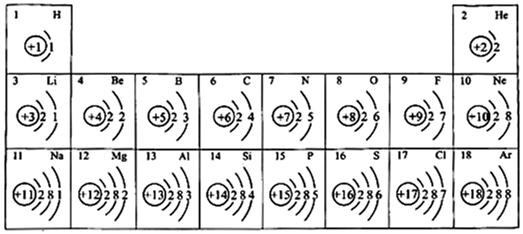 (1)、原子序数为4的元素符号为。(2)、C、N、O排在同一周期是因为(填“质子数”“电子层数”或“最外层电子数”)相同。(3)、He和Mg的化学性质(填“相似”或“不相似”)。(4)、画出Na+的结构示意图。(5)、一个磷原子含有个质子,一个NH 含有个电子。14. 不同元素的原子在分子内吸引电子的能力大小可用一数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的X值。
(1)、原子序数为4的元素符号为。(2)、C、N、O排在同一周期是因为(填“质子数”“电子层数”或“最外层电子数”)相同。(3)、He和Mg的化学性质(填“相似”或“不相似”)。(4)、画出Na+的结构示意图。(5)、一个磷原子含有个质子,一个NH 含有个电子。14. 不同元素的原子在分子内吸引电子的能力大小可用一数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的X值。元素
Li
Be
B
C
O
F
X值
0.98
1.57
2.04
2.53
3.44
3.98
元素
Na
Al
Si
P
S
Cl
X值
0.93
1.61
1.90
2.19
2.58
3.16
(1)、通过分析X值的变化规律,确定N、Mg的X值范围:<X(Mg)<;<X(N)<.(2)、推测X值与原子半径的关系是.(3)、某有机物结构简式为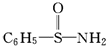 ,在S∼N中,你认为共用电子对偏向谁?(写原子名称). (4)、经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是(5)、预测元素周期表中,X值最小的元素位置(放射性元素除外).15. a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:(1)、写出b元素在周期表中的位置;(2)、写出一种由a、c、d所形成的离子化合物 (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是;(3)、c的单质的电子式为。(4)、b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是(选填字母序号)。
,在S∼N中,你认为共用电子对偏向谁?(写原子名称). (4)、经验规律告诉我们当成键的两原子相应元素电负性的差值△X>1.7时,一般为离子键,当△X<1.7时,一般为共价键,试推断AlBr3中化学键的类型是(5)、预测元素周期表中,X值最小的元素位置(放射性元素除外).15. a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:(1)、写出b元素在周期表中的位置;(2)、写出一种由a、c、d所形成的离子化合物 (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是;(3)、c的单质的电子式为。(4)、b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是(选填字母序号)。A.常温下,b的单质呈固态,d的单质呈气态
B.d的氢化物的稳定性强于b的氢化物
C.b与d形成的化合物中,b呈正价
D.d的氢化物的沸点高于b的氢化物