浙江省宁波十校2019-2020学年高三下学期化学3月月考试卷
试卷更新日期:2021-03-10 类型:月考试卷
一、单选题
-
1. 下列物质中属于碱性氧化物的是( )A、Al2O3 B、SO2 C、CaO D、NaOH2. 分液时需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列属于有机物,又是强电解质的是( )A、硬脂酸钠 B、甘油 C、苯酚 D、硝基苯4. 下列属于氧化还原反应的是( )A、NH4Cl+NaOH NH3↑+NaCl+H2O B、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O C、Na2O2+2H2O=2NaOH+H2O2 D、SO2+H2O=H2SO35. 下列物质的名称错误的是( )A、FeS2:二硫化亚铁 B、CaSO4·2H2O:熟石膏 C、CO(NH2)2:尿素 D、CH3CH2CH2CH3:正丁烷6. 下列表示正确的是( )A、镁离子的结构示意图:Mg2+ B、二氧化硅的分子式:SiO2 C、乙醇的结构简式:C2H5OH D、水分子的球棍模型:
3. 下列属于有机物,又是强电解质的是( )A、硬脂酸钠 B、甘油 C、苯酚 D、硝基苯4. 下列属于氧化还原反应的是( )A、NH4Cl+NaOH NH3↑+NaCl+H2O B、MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O C、Na2O2+2H2O=2NaOH+H2O2 D、SO2+H2O=H2SO35. 下列物质的名称错误的是( )A、FeS2:二硫化亚铁 B、CaSO4·2H2O:熟石膏 C、CO(NH2)2:尿素 D、CH3CH2CH2CH3:正丁烷6. 下列表示正确的是( )A、镁离子的结构示意图:Mg2+ B、二氧化硅的分子式:SiO2 C、乙醇的结构简式:C2H5OH D、水分子的球棍模型: 7. 下列说法正确的是( )A、 Pu与 U互为同位素 B、H2O和D2O互为同素异形体 C、醋酸和软脂酸互为同系物 D、新戊烷和2,2-二甲基丙烷互为同分异构体8. 下列说法错误的是( )A、白磷有毒因此必须保存在水中,取用时要用镊子 B、纯碱在食品、石油等工业中有着广泛的应用 C、碘是一种重要的药用元素,也是生产含碘食品的必要元素 D、工业上利用氢气和氯气反应来制备盐酸9. 下列说法错误的是( )A、制备铜氨纤维时,取出稀盐酸中的生成物,用水洗涤,得到蓝色的铜氨纤维 B、天然气的主要成分是甲烷,不同地区天然气中甲烷含量不同 C、长久存放的氯水逐渐转变为很稀的盐酸 D、在燃烧木柴时,将木材架空,木材会燃烧的更旺10. 下列说法错误的是( )A、甲烷和氯气1:1混合,光照下反应很难得到纯净的二氯甲烷 B、在压强较低时,重油中的烃会在相对较低的温度下发生汽化 C、燃烧植物枝叶是生物质的热化学转化,远古时期人们用此进行取热 D、氨水法脱硫既可以消除煤烟气中二氧化硫,还可以获得石膏与硫酸铵11. 下列有关实验说法,错误的是( )A、沉淀的颗粒较大且易沉降时,也可用倾析的方法将固体与溶液分离 B、可用纸层析法分离含少量Fe3+和Cu2+的混合溶液,亲水性强的Cu2+在滤纸条的下方 C、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度 D、强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗12. 下列关于氮及其化合物的说法错误的是( )A、所有的铵盐都可能与烧碱共热生成氨气 B、浓硝酸不论与铜或碳反应,均体现其强氧化性 C、硝酸是一种黄色、具有一定挥发性的酸,保存时不可用橡胶塞 D、把带火星的木条伸入充满NO2和O2混合气体(NO2和O2的物质的量之比为4:1)的集气瓶中,木条复燃,说明NO2支持燃烧13. 下列指定反应的离子方程式正确的是( )A、碳酸氢钠的水解方程式:HCO3-+H2O CO32-+H3O+ B、用高锰酸钾标准溶液滴定草酸:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O C、用碳酸氢钠溶液检验水杨酸中的羧基:
7. 下列说法正确的是( )A、 Pu与 U互为同位素 B、H2O和D2O互为同素异形体 C、醋酸和软脂酸互为同系物 D、新戊烷和2,2-二甲基丙烷互为同分异构体8. 下列说法错误的是( )A、白磷有毒因此必须保存在水中,取用时要用镊子 B、纯碱在食品、石油等工业中有着广泛的应用 C、碘是一种重要的药用元素,也是生产含碘食品的必要元素 D、工业上利用氢气和氯气反应来制备盐酸9. 下列说法错误的是( )A、制备铜氨纤维时,取出稀盐酸中的生成物,用水洗涤,得到蓝色的铜氨纤维 B、天然气的主要成分是甲烷,不同地区天然气中甲烷含量不同 C、长久存放的氯水逐渐转变为很稀的盐酸 D、在燃烧木柴时,将木材架空,木材会燃烧的更旺10. 下列说法错误的是( )A、甲烷和氯气1:1混合,光照下反应很难得到纯净的二氯甲烷 B、在压强较低时,重油中的烃会在相对较低的温度下发生汽化 C、燃烧植物枝叶是生物质的热化学转化,远古时期人们用此进行取热 D、氨水法脱硫既可以消除煤烟气中二氧化硫,还可以获得石膏与硫酸铵11. 下列有关实验说法,错误的是( )A、沉淀的颗粒较大且易沉降时,也可用倾析的方法将固体与溶液分离 B、可用纸层析法分离含少量Fe3+和Cu2+的混合溶液,亲水性强的Cu2+在滤纸条的下方 C、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度 D、强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗12. 下列关于氮及其化合物的说法错误的是( )A、所有的铵盐都可能与烧碱共热生成氨气 B、浓硝酸不论与铜或碳反应,均体现其强氧化性 C、硝酸是一种黄色、具有一定挥发性的酸,保存时不可用橡胶塞 D、把带火星的木条伸入充满NO2和O2混合气体(NO2和O2的物质的量之比为4:1)的集气瓶中,木条复燃,说明NO2支持燃烧13. 下列指定反应的离子方程式正确的是( )A、碳酸氢钠的水解方程式:HCO3-+H2O CO32-+H3O+ B、用高锰酸钾标准溶液滴定草酸:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O C、用碳酸氢钠溶液检验水杨酸中的羧基: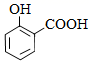 +2HCO3-→
+2HCO3-→ 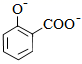 +2H2O+2CO2↑
D、向Na2SiO3溶液中滴加稀盐酸:Na2SiO+2H+=H2SiO3↓+2Na+
14. 下列说法错误的是( )A、等质量的甲烷和乙酸分别充分燃烧,消耗氧气的量相同 B、麦芽糖分子式为C12H22O11 , 能发生银镜反应 C、用新制氢氧化铜溶液可鉴别丙酸和丙醛两种无色液体 D、油脂的硬化反应属于加成反应15. 分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )
+2H2O+2CO2↑
D、向Na2SiO3溶液中滴加稀盐酸:Na2SiO+2H+=H2SiO3↓+2Na+
14. 下列说法错误的是( )A、等质量的甲烷和乙酸分别充分燃烧,消耗氧气的量相同 B、麦芽糖分子式为C12H22O11 , 能发生银镜反应 C、用新制氢氧化铜溶液可鉴别丙酸和丙醛两种无色液体 D、油脂的硬化反应属于加成反应15. 分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )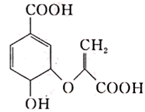 A、分子中含有4种含氧官能团 B、分枝酸一定条件下可以发生缩聚反应但不能发生加聚反应 C、1mol分枝酸最多可与2molNaOH发生中和反应 D、可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同16. 短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中X与其它元素均不位于同一周期,Y和W的原子序数相差8,Y、Z、W三种原子的最外层电子数之和为16,X、Z的最高正价和最低负价的代数和均为0。下列说法正确的是( )A、氧化物对应的水化物的酸性:M>W B、原子半径的大小顺序:r(M)>r(Z)>r(Y) C、化合物的稳定性:ZX4>XM D、X和Y,W和M均可能形成原子个数比为1:1的分子17. 能证明亚硝酸是弱酸的实验事实是( )A、HNO2的酸性比CH3COOH强 B、0.1mol/LNaNO2溶液的pH大于7 C、HNO2溶液与Na2CO3反应生成CO2 D、HNO2不稳定可分解成NO和NO218. 以铅蓄电池为电源电解制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向。下列说法正确的是( )
A、分子中含有4种含氧官能团 B、分枝酸一定条件下可以发生缩聚反应但不能发生加聚反应 C、1mol分枝酸最多可与2molNaOH发生中和反应 D、可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同16. 短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中X与其它元素均不位于同一周期,Y和W的原子序数相差8,Y、Z、W三种原子的最外层电子数之和为16,X、Z的最高正价和最低负价的代数和均为0。下列说法正确的是( )A、氧化物对应的水化物的酸性:M>W B、原子半径的大小顺序:r(M)>r(Z)>r(Y) C、化合物的稳定性:ZX4>XM D、X和Y,W和M均可能形成原子个数比为1:1的分子17. 能证明亚硝酸是弱酸的实验事实是( )A、HNO2的酸性比CH3COOH强 B、0.1mol/LNaNO2溶液的pH大于7 C、HNO2溶液与Na2CO3反应生成CO2 D、HNO2不稳定可分解成NO和NO218. 以铅蓄电池为电源电解制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向。下列说法正确的是( )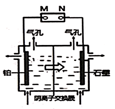 A、M发生的电极反应为PbO2+SO42-+4H+=PbSO4+2H2O B、左侧气孔逸出的气体可能为副产物O2 C、电解槽中发生的总反应为:2MnSO4+2H2O 2Mn+O2↑+2H2SO4 D、若用阳离子交换膜代替阴离子交换膜,阴极可能得到MnO219. 下列说法正确的是( )A、BF3和PCl3中,每个原子的最外层都具有8电子稳定结构 B、乙醇的沸点高于二甲醚(CH3OCH3)是因为乙醇分子间存在氢键 C、NaHSO4固体溶于水时,只破坏了离子键 D、CaO2和CaCl2中含有的化学键类型完全相同20. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,71gCl2溶于足量水,所得溶液中Cl2、HClO和ClO-三种微粒总数为NA B、pH=2的CH3COOH溶液中,H+的数目为0.01NA C、将5.6g铁块投入一定量的稀硝酸中,恰好完全反应,一定转移0.3NA个电子 D、用电解法精炼铜时,若电路中转移2mol电子,阳极质量减轻64g21. 在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
A、M发生的电极反应为PbO2+SO42-+4H+=PbSO4+2H2O B、左侧气孔逸出的气体可能为副产物O2 C、电解槽中发生的总反应为:2MnSO4+2H2O 2Mn+O2↑+2H2SO4 D、若用阳离子交换膜代替阴离子交换膜,阴极可能得到MnO219. 下列说法正确的是( )A、BF3和PCl3中,每个原子的最外层都具有8电子稳定结构 B、乙醇的沸点高于二甲醚(CH3OCH3)是因为乙醇分子间存在氢键 C、NaHSO4固体溶于水时,只破坏了离子键 D、CaO2和CaCl2中含有的化学键类型完全相同20. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,71gCl2溶于足量水,所得溶液中Cl2、HClO和ClO-三种微粒总数为NA B、pH=2的CH3COOH溶液中,H+的数目为0.01NA C、将5.6g铁块投入一定量的稀硝酸中,恰好完全反应,一定转移0.3NA个电子 D、用电解法精炼铜时,若电路中转移2mol电子,阳极质量减轻64g21. 在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法错误的是( )
A、实验①中,若5min未测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速v(N)=1.0×10-3mol·L-1·min-1 B、实验②中,达到平衡时,Y的转化率为20% C、实验③中,该反应的平衡常数K=1.0 D、实验④中,达到平衡时, b>0.06022. 已知分解1molH2O2放出热最98kJ,在含少量I-的溶液中,H2O2分解的机理为:反应Ⅰ:H2O2(aq)+I-(aq)→H2O(l)+IO-(aq) 慢反应 ΔH1
反应Ⅱ:H2O2(aq)+IO-(aq)→H2O(l)+O2(g)+I-(aq) 快反应 ΔH2
下列有关该反应的说法正确的是( )
A、H2O2分解产生O2的速率反应Ⅱ决定 B、I-和IO-在反应过程中充当催化剂 C、ΔH1+ΔH2=−196 kJ·mol−1 D、反应Ⅰ活化能Ea1与反应Ⅱ活化能Ea2数值上相差98kJ/mol23. 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析错误的是( )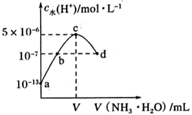 A、V=20 B、b点所示溶液中:c(NH4+)>2c(SO42-)>c(H+)>c(OH-) C、d点所溶液中:c(NH4+)+c(OH-)=2c(SO42-)+c(H+) D、NH3·H2O的电离常数K≈2×10-524. 家用消毒剂种类繁多,医用酒精(75%的乙醇水溶液)、84消毒液(次氯酸钠溶液)、高锰酸钾消毒片、滴塔消毒液(氯间二甲苯酚)等,消毒剂之间切不可随意相互混用。下列说法错误的是( )A、医用酒精和84消毒液混合,乙醇可能将次氯酸钠还原从而产生氯气引起危险 B、高锰酸钾消毒片放入滴露消毒液中,高锰酸钾可能将氯间二甲苯酚氧化从而降低消毒效果 C、84消毒液和滴露消毒液混用洗衣服时,消毒效果会降低很多,也有可能产生氯气 D、高锰酸钾消毒片投入到84消毒液时,有可能高锰酸钾将次氯酸钠氧化而产生氯气25. 固体粉末X中可能含有K2SO3、KAlO2、AgNO3、Na2CO3中的一种或几种。为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如图:
A、V=20 B、b点所示溶液中:c(NH4+)>2c(SO42-)>c(H+)>c(OH-) C、d点所溶液中:c(NH4+)+c(OH-)=2c(SO42-)+c(H+) D、NH3·H2O的电离常数K≈2×10-524. 家用消毒剂种类繁多,医用酒精(75%的乙醇水溶液)、84消毒液(次氯酸钠溶液)、高锰酸钾消毒片、滴塔消毒液(氯间二甲苯酚)等,消毒剂之间切不可随意相互混用。下列说法错误的是( )A、医用酒精和84消毒液混合,乙醇可能将次氯酸钠还原从而产生氯气引起危险 B、高锰酸钾消毒片放入滴露消毒液中,高锰酸钾可能将氯间二甲苯酚氧化从而降低消毒效果 C、84消毒液和滴露消毒液混用洗衣服时,消毒效果会降低很多,也有可能产生氯气 D、高锰酸钾消毒片投入到84消毒液时,有可能高锰酸钾将次氯酸钠氧化而产生氯气25. 固体粉末X中可能含有K2SO3、KAlO2、AgNO3、Na2CO3中的一种或几种。为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如图: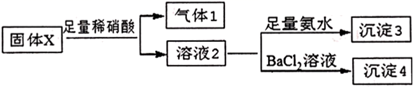
根据上述实验,固体粉末 的组合错误的是( )
A、KAlO2、AgNO3、Na2CO3 B、K2SO3、AgNO3、Na2CO3 C、K2SO3、KAlO2、Na2CO3 D、K2SO3、KAlO2、AgNO3二、综合题
-
26.(1)、已知金刚石中C-C键能小于C60中C-C键能,有同学据此认为C60的熔点高于金刚石,认为此说法是否正确(填“正确”或“不正确”),并闸述理由。(2)、格式试剂RMgX(R表示烃基、X表示卤素)遇水剧烈反应,生成可燃性烃RH和 。(3)、64g自燃性气体SiH4在25℃、101Kpa下充分完全燃烧生成液态水和固态氧化物时放出akJ热量,写出该自燃性气体燃烧热的热化学方程式。
三、计算题
-
27. 将两种硫酸盐按一定比例混合后共熔,可制得化合物M(化学式为xK2SO4·yCr2(SO4)3),若将2.83g化合物M中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81gI2 , 反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr2O72-+3I2+7H2O,若向溶有2.83gM的溶液中,加入过量的BaCl2溶液,过滤洗涤干燥后可得到4.66g白色沉淀。
由此推断出化合物M中x:y为。写出简要计算过程:。
28. 某淡黄色固体A(仅含三种元素,式量小于160)可用于制药,为探究其组成和性质,设计并完成如下实验: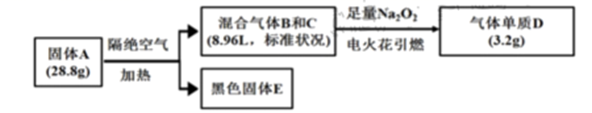
已知:①上述流程中所涉及的反应都充分进行。
②B、C、D均为常见气体。相同情况下气体B的密度大气体C。
③黑色固体 溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
请问答:
(1)、写出气体B的电子式 , 固体A的化学式是。(2)、黑色固体E与足量浓硝酸反应的离子反应方程式是。29. 辣椒的味道主要来自辣椒素类化合物。辣椒素作为一种生物碱广泛用于食品保健、医药工业等领域。辣椒素的合成路线如图:
已知:a.-NH2 -NHCOCH3;
b.-CH(COOH)2 -CH2COOH+CO2;
请问答:
(1)、下列说法正确的是________。A、化合物B能发生加成、酯化、氧化、还原反应 B、化合物C能与氢氧化铜发生反应 C、试剂X既能和强酸反应又可以和强碱反应 D、辣椒素的分子式是C18H27NO3(2)、写出C的结构简式。(3)、写出A+B→C的化学方程式。(4)、已知: ,请结合题中所给的信息,写出由
,请结合题中所给的信息,写出由  制备
制备  的合成路线流程图(无机试剂任选)。。 (5)、写出试剂X(C8H11NO2)同时符合下列条件的所有同分异构体的结构简式。
的合成路线流程图(无机试剂任选)。。 (5)、写出试剂X(C8H11NO2)同时符合下列条件的所有同分异构体的结构简式。①是苯环上有二种氢,不能使FeCl3显色,IR谱表明分中无N-O键
②1mol该物质与足量Na发生反应放出1molH2(不考虑同一个碳上连2个-OH)
30. 用SiHCl3在加热条件下与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):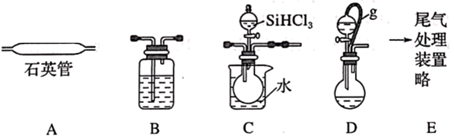
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:
(1)、依次连接的合理顺序为。(2)、操作时应先打开装置(选填“C”或“D”)中分液漏斗的旋塞,理由是。31. 气体之间的反应有其独特的优点,对其研究具有重要意义。(1)、在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__。
A、H2的消耗速率是CH3OH生成速率的2倍 B、CH3OH的体积分数不再改变 C、混合气体的密度不再改变 D、CO和CH3OH的物质的量之比保持不变(2)、CO(g)+2H2(g) CH3OH(g)在(填“低温”、“高温”或“任意温度”)下能自发进行。(3)、化学平衡常数K(B)、K(C)、K(D)的大小关系是:。(4)、计算图中A点的平衡常数Kp=。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
(5)、已知NH3(g)+NOx(g)+O2(g) N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。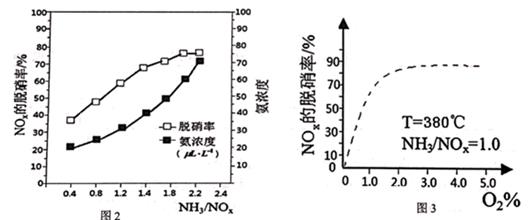 ①图2中,最佳氨氮比为2.0,理由是 。
①图2中,最佳氨氮比为2.0,理由是 。②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示。
32. 轻质碳酸钙是一种广泛应用的工业填料,主要用于塑料、造纸、橡胶和涂料等。工业上以磷石膏(主要成分为CaSO4 , 杂质主要是SiO2、FeO、Fe2O3、Al2O3等)为原料制备轻质碳酸钙。已知碳酸钙的溶解度比硫酸钙的溶解度小,在一定温度下,钙离子开始沉淀的pH值为12.3,氢氧化铝开始溶解的pH值为12.0,其他金属离子形成氢氧化物沉淀的相关pH的范围如下:金属离子
开始沉淀的pH
沉淀完全的pH
Fe3+
1.5
2.8
Fe2+
5.5
8.3
Al3+
3.0
4.7
制备流程如图:
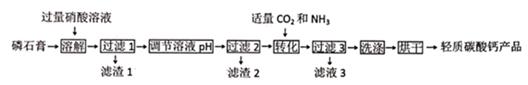
请问答:
(1)、以下说法正确的是 。A、溶解的过程中,可以用盐酸代替硝酸 B、滤渣1的主要成分是SiO2 , 滤渣2的上要成分是Fe(OH)3、Al(OH)3 C、转化时,可以先通氨气至饱和后再通过量二氧化碳,以提高钙离子的转化率 D、转化时可以适当加热,以加快反应速率 E、洗涤时可以采用滤液3(2)、调节溶液pH范围时,最佳的pH范围是 , 理由是。(3)、碳酸钙产品中钙含量的测定:用电子天平准确称量产品2.000g于干净的烧杯中,滴加2mol/L的盐酸恰好完全溶解,加蒸馏水继续蒸发除去过量的酸至pH=6~7,转移至250mL的容量瓶中,定容摇匀。用移液管准确移取25.00mL溶液于锥形瓶中,加入NaOH溶液10mL,摇匀,加入钙指示剂30mg,用已标定的EDTA(乙二胺四乙酸,可以表示为H4Y)标准溶液进行滴定。
已知:Ca2++Y4-=[CaY]2- , 测定数据如下:
待测产品溶液体积(mL)
消耗EDTA标准溶液体积(mL)
EDTA标准溶液的浓度(mol)
1
25.00
14.90
0.1121
2
25.00
16.72
0.1121
3
25.00
15.00
0.1121
4
25.00
15.10
0.1121
①进行整个滴定操作实验的过程中,下列操作方法正确的是。
A.使用移液管移取溶液的时候,移液管尖嘴不能接触容器壁
B.滴定管水洗后,需要用标准溶液润洗3次,再排出气泡,使液面位于“0”刻度或“0”刻度以下
C.滴定管调液面后,需静置1~2min,再进行读取刻度数据进行记录
D.电子天平读数时,两边侧面应同时处于打开状态,使空气保持流通
②该产品中钙元素的质量分数为(保留两位有效数字),若滴定结束时仰视读数,则测定的结果(填“偏大”、“偏小”或“无影响”)。
-