广东省汕头市金山中学2019-2020学年高三下学期化学6月理综试卷
试卷更新日期:2021-03-10 类型:月考试卷
一、单选题
-
1. 下列对古文献记载内容理解错误的是( )A、《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作时如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”中药材铁华粉是醋酸亚铁 B、唐代《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手、面及屋舍者”,描述了黑火药制作过程 C、《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取涉及到升华操作 D、《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应2. 化合物c的制备原理如下:
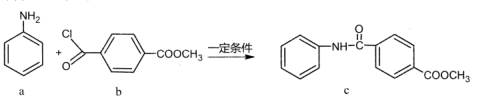
下列说法正确的是( )
A、该反应为加成反应 B、化合物a中所有原子一定共平面 C、化合物C的一氯代物种类为5种 D、化合物b、c均能与NaOH溶液反应3. 我国科学家提出用CO2置换可燃冰(mCH4·nH2O) 中CH4的设想,置换过程如图所示,下列说法正确的是( )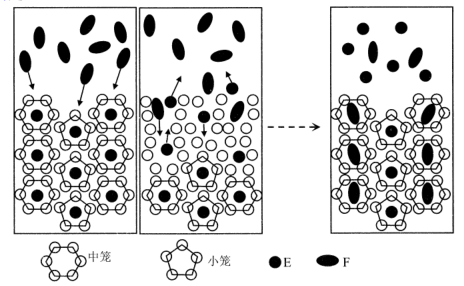 A、E代表CO2 , F代表CH4 B、笼状结构中水分子间主要靠氢键结合 C、CO2置换出CH4的过程是化学变化 D、CO2可置换可燃冰中所有的CH4分子4. 双极电化学法(装置如图)是在传统电解装置中放置了导电性电极BPE,通电时,BPE两端界面产生电势差,生成梯度合金。下列有关说法错误的是( )
A、E代表CO2 , F代表CH4 B、笼状结构中水分子间主要靠氢键结合 C、CO2置换出CH4的过程是化学变化 D、CO2可置换可燃冰中所有的CH4分子4. 双极电化学法(装置如图)是在传统电解装置中放置了导电性电极BPE,通电时,BPE两端界面产生电势差,生成梯度合金。下列有关说法错误的是( )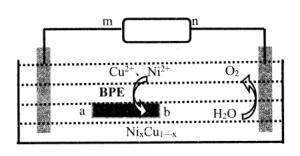 A、m为电源负极 B、BPE的b端比a端的电势高 C、BPE的a端发生的反应为: 2H2O+2e-=H2↑+2OH- D、BPE的b端到中心的不同位置,能形成组成不同的铜镍合金5. 利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法错误的是( )
A、m为电源负极 B、BPE的b端比a端的电势高 C、BPE的a端发生的反应为: 2H2O+2e-=H2↑+2OH- D、BPE的b端到中心的不同位置,能形成组成不同的铜镍合金5. 利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法错误的是( ) A、常温下,绿原酸易溶于水 B、浸膏的主要成分是绿原酸 C、减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质 D、绿原酸粗产品可以通过重结晶进一步提纯6. “医用酒精”和“84消毒液”混合,产生ZQ、X2W4Y、XW3Q等多种物质,已知W、X、Y、Z、Q为原子序数依次增大的短周期主族元素。下列叙述错误的是( )A、简单气态氢化物热稳定性: Y>X B、W与Z可形成离子化合物ZW C、简单离子半径: Q->Y2->Z+ D、常温下,XW3Q为气态,且X、W、Q均满足8电子稳定结构7. 向废水中加入硫化物可以依次获得CuS、ZnS纳米粒子。常温下,H2S
A、常温下,绿原酸易溶于水 B、浸膏的主要成分是绿原酸 C、减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质 D、绿原酸粗产品可以通过重结晶进一步提纯6. “医用酒精”和“84消毒液”混合,产生ZQ、X2W4Y、XW3Q等多种物质,已知W、X、Y、Z、Q为原子序数依次增大的短周期主族元素。下列叙述错误的是( )A、简单气态氢化物热稳定性: Y>X B、W与Z可形成离子化合物ZW C、简单离子半径: Q->Y2->Z+ D、常温下,XW3Q为气态,且X、W、Q均满足8电子稳定结构7. 向废水中加入硫化物可以依次获得CuS、ZnS纳米粒子。常温下,H2S Ka1=1.3×10-7 , Ka2=7.1×10-15 , 溶液中平衡时相关离子浓度的关系如图,下列说法错误的是( )
Ka1=1.3×10-7 , Ka2=7.1×10-15 , 溶液中平衡时相关离子浓度的关系如图,下列说法错误的是( ) 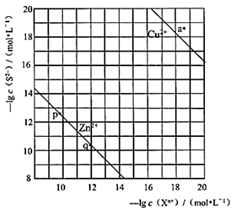 A、Ksp(CuS)的数量级为10-37 B、a点对应的CuS溶液为不饱和溶液 C、向p点的溶液中加入少量Na2S固体,溶液组成由p向q方向移动 D、H2S+Zn2+ ZnS + 2H+平衡常数很大,反应趋于完全
A、Ksp(CuS)的数量级为10-37 B、a点对应的CuS溶液为不饱和溶液 C、向p点的溶液中加入少量Na2S固体,溶液组成由p向q方向移动 D、H2S+Zn2+ ZnS + 2H+平衡常数很大,反应趋于完全二、综合题
-
8. 钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如下图所示。
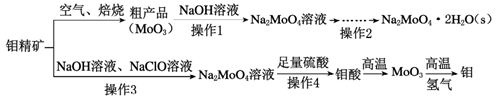
回答下列问题:
(1)、如果在空气中焙烧1mol MoS2时,S转移12mol电子,则MoS2中钼元素的化合价为;焙烧产生的尾气对环境的主要危害是。(2)、若在实验室中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是 , 过滤、洗涤、干燥。(3)、钼精矿中MoS2含量的测定:取钼精矿16g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体(Na2MoO4·2H2O)12.1g(假设各步的转化率均为100%),钼精矿中MoS2的质量分数为。(已知MoS2的相对分子质量为160,Na2MoO4·2H2O的相对分子质量为242)。(4)、操作3硫元素被氧化为最高价,发生反应的离子方程式为。(5)、用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图所示。b电极上的电极反应式为。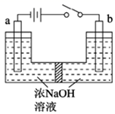 (6)、某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,该温度下BaMoO4的Ksp的值为。
(6)、某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,该温度下BaMoO4的Ksp的值为。 9. 茉莉醛被广泛应用于食品、化妆品和洗涤剂中。实验室制备茉莉醛的反应:
9. 茉莉醛被广泛应用于食品、化妆品和洗涤剂中。实验室制备茉莉醛的反应: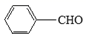 +CH3(CH2)5CHO
+CH3(CH2)5CHO 
 +H2O,有关数据如下表:
+H2O,有关数据如下表: 相对分子质量
密度/g·cm-3
沸点/℃
苯甲醛
106
1.04
179
庚醛
114
0.85
153
茉莉醛
202
0.97
287
实验室制备茉莉醛的装置示意图如下:

实验步骤:
在a中加入5.30 mL苯甲醛、5 mL95%乙醇、12 mL10%KOH溶液,在c中加入6.84 g庚醛。搅拌并加热至60~65℃,打开c向a中缓慢滴加庚醛。保温搅拌反应3 h。反应待冷却后,静置分层,分出有机层,水层用20 mL二氯甲烷分两次萃取,萃取分液后与有机层合并,有机层再用10 mL水洗涤3次,洗涤后加入无水Na2SO4。蒸馏,收集287~290℃馏分,馏分用柱色谱法进行分离,得纯净的茉莉醛4.04g。已知:柱色谱分离中,先将液体样品从柱顶加入,流经吸附柱时,即被吸附在柱的上端,然后从柱顶加入洗脱剂,由于吸附剂对各组分吸附能力不同,各组分以不同速度沿柱下移,从而达到分离的效果。
回答下列问题:
(1)、仪器a的名称是 , 实验中应采取的加热方法是。(2)、在洗涤操作中,用水洗涤的主要目的是 , 加入无水Na2SO4的目的是。(3)、用二氯甲烷萃取分液时,水层在(填“上”或“下”)层。(4)、柱色谱法分离中使用的吸附剂为硅胶或碳酸钙,除此之外,还可以使用(填序号)①活性炭 ②氯化钠 ③氧化铝 ④碳酸钾
(5)、柱色谱法分离过程中,如果洗脱剂加入速度太快,会使产品产率(填“偏高”、“不变”、“偏低”)(6)、本实验所得茉莉醛产率为%。三、原理综合题
-
10. 十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g)⇌CaO(s)+SO2(g)+CO2(g)活化能Ea1 , ΔH1=+218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)⇌CaS(s)+4CO2(g)活化能Ea2 , ΔH2=-175.6kJ·mol-1
已知活化能Ea1< Ea2。请回答下列问题:
(1)、反应CaO(s)+3CO(g)+SO2(g)⇌CaS(s)+3CO2(g);△H=kJ•mol-1;该反应在(填“高温”“低温”“任意温度”)时可自发进行。(2)、恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。t min中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp , 如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。(3)、下图为1000 K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图象。请分析下图曲线中c(SO2)在0~t2区间变化的原因。 (4)、下图为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比 与SO2体积分数的关系曲线。下列有关叙述正确的是_______。(填序号)
(4)、下图为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比 与SO2体积分数的关系曲线。下列有关叙述正确的是_______。(填序号) A、当体系中气体的密度不再变化时,反应I和反应Ⅱ都已达到平衡状态 B、提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大 C、其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫11. 科学家预测21世纪中叶将进入“氢能经济”时代,许多化合物或合金都是具有广阔应用前景的储氢材料。回答下列问题:(1)、基态Li原子核外电子有种不同的运动状态,占据最高能层电子的电子云轮廓图形状为 。(2)、Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为。(3)、亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是。(4)、咔唑(
A、当体系中气体的密度不再变化时,反应I和反应Ⅱ都已达到平衡状态 B、提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大 C、其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫11. 科学家预测21世纪中叶将进入“氢能经济”时代,许多化合物或合金都是具有广阔应用前景的储氢材料。回答下列问题:(1)、基态Li原子核外电子有种不同的运动状态,占据最高能层电子的电子云轮廓图形状为 。(2)、Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为。(3)、亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是。(4)、咔唑( )的沸点比芴(
)的沸点比芴( 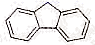 )高的主要原因是。 (5)、NH3BH3 (氨硼烷,熔点104℃)与(写出一种分子)互为等电子体。可通过红外光谱测定该分子的立体构型,NH3BH3中B的杂化轨道类型为。(6)、一种储氢合金的晶胞结构如图所示。在晶胞中Cu原子处于面心,Au原子处于顶点位置。该晶体中,原子之间的作用力是。实现储氢功能时,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为。
)高的主要原因是。 (5)、NH3BH3 (氨硼烷,熔点104℃)与(写出一种分子)互为等电子体。可通过红外光谱测定该分子的立体构型,NH3BH3中B的杂化轨道类型为。(6)、一种储氢合金的晶胞结构如图所示。在晶胞中Cu原子处于面心,Au原子处于顶点位置。该晶体中,原子之间的作用力是。实现储氢功能时,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为。
四、有机推断题
-
12. 某药物H的一种合成路线如下:
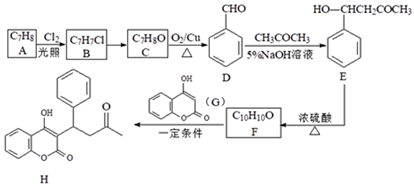
回答下列问题:
(1)、C的名称是。(2)、F→H的反应类型为 , B→C的试剂和条件是。(3)、H有多种同分异构体,在下列哪种仪器中可以显示物质中化学键和官能团类型_____(填字母)。A、质谱仪 B、元素分析仪 C、红外光谱仪 D、核磁共振氢谱仪(4)、写出D→E的化学方程式。(5)、在E的同分异构体中,同时满足下列条件的结构有种;其中核磁共振氢谱有六组峰,且峰面积之比为3:3:2:2:1:1的是。①既能发生银镜反应,又能发生水解反应;
②属于芳香族化合物;
③苯环上只有2个取代基。
(6)、参照上述流程,以D和乙醛为原料合成 (其它无机试剂自选),设计合成路线。
(其它无机试剂自选),设计合成路线。