河北衡水中学2019-2020学年高三下学期化学3月月考试卷
试卷更新日期:2021-03-10 类型:月考试卷
一、单选题
-
1. 化学与生活密切相关,下列有关说法错误的是( )A、用灼烧的方法可以区分蚕丝和人造纤维 B、食用油反复加热会产生稠环芳香烃等有害物质 C、加热能杀死流感病毒是因为蛋白质受热变性 D、医用消毒酒精中乙醇的浓度为95%2. 下列有关化学用语表示正确的是( )A、中子数为10的氧原子: B、Mg2+的结构示意图:
 C、硫化钠的电子式:
C、硫化钠的电子式:  D、甲酸甲酯的结构简式:C2H4O2
3. 常压下羰基化法精炼镍的原理:Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4 的沸点为 42.2 ℃,固体杂质不参与反应。
D、甲酸甲酯的结构简式:C2H4O2
3. 常压下羰基化法精炼镍的原理:Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4 的沸点为 42.2 ℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230 ℃制得高纯镍。下列判断正确的是( )
A、增加 c(CO),平衡向正向移动,反应的平衡常数增大 B、该反应达到平衡时, 生成[Ni(CO)4])=4 生成(CO) C、第一阶段,在 30 ℃和 50 ℃两者之间选择反应温度,选50 ℃ D、第二阶段,Ni(CO)4分解率较低4. 常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )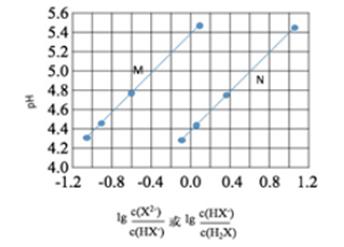 A、Ka2(H2X)的数量级为10–6 B、曲线N表示pH与 的变化关系 C、NaHX溶液中c(H+)>c(OH-) D、当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)5. 实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )
A、Ka2(H2X)的数量级为10–6 B、曲线N表示pH与 的变化关系 C、NaHX溶液中c(H+)>c(OH-) D、当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)5. 实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )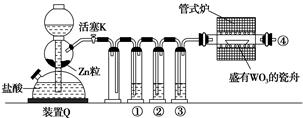 A、①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B、管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C、结束反应时,先关闭活塞K,再停止加热 D、装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气6. 以下实验设计能达到实验目的的是( )
A、①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B、管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C、结束反应时,先关闭活塞K,再停止加热 D、装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气6. 以下实验设计能达到实验目的的是( )选项
实验目的
实验设计
A
除去NaHCO3固体中的Na2CO3
将固体加热至恒重
B
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
C
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
D
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
A、A B、B C、C D、D7. 我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下: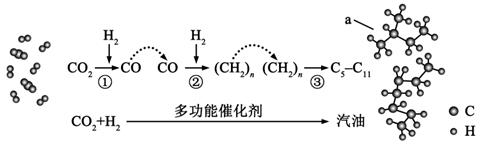
下列说法错误的是( )
A、反应①的产物中含有水 B、反应②中只有碳碳键形成 C、汽油主要是C5~C11的烃类混合物 D、图中a的名称是2-甲基丁烷二、综合题
-
8. [化学-选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
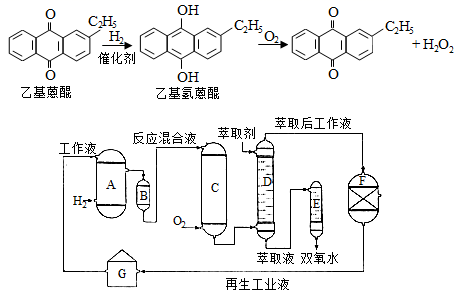
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E.净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)、蒽醌法制备双氧水理论上消耗的原料是 , 循环使用的|原料是 , 配制工作液时采用有机溶剂而不采用水的原因是。(2)、氢化釜A中反应的化学方程式为 , 进入氧化塔C的反应混合液中的主要溶质为。(3)、萃取塔D中的萃取剂是 , 选择其作萃取剂的原因是。(4)、工作液再生装置F中要除净残留的H2O2 , 原因是。(5)、双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为mol/L。9. 丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:(1)、正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为 kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号)。

A.升高温度 B.降低温度 C.增大压强 D.降低压强
(2)、丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是。(3)、图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是。10. 我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:(1)、氮原子价层电子对的轨道表达式(电子排布图)为。(2)、元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是。(3)、经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。①从结构角度分析,R中两种阳离子的相同之处为 , 不同之处为。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为个。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则N5-中的大π键应表示为。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、、。
 (4)、R的晶体密度为d g·cm-3 , 其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M , 则y的计算表达式为。11. 酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2 , ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据如表所示:
(4)、R的晶体密度为d g·cm-3 , 其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M , 则y的计算表达式为。11. 酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2 , ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据如表所示:溶解度/(g/100g水)
0
20
40
60
80
100
NH4Cl
29.3
37.2
45.8
55.3
65.6
77.3
ZnCl2
343
395
452
488
541
614
溶度积常数
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp近似值
10-17
10-17
10-39
回答下列问题:
(1)、该电池的正极反应式为 , 电池反应的离子方程式为(2)、维持电流强度为0.5A,电池工作五分钟,理论上消耗Zng。(已经F=96500C/mol)(3)、废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过分离回收;滤渣的主要成分是MnO2、和 , 欲从中得到较纯的MnO2 , 最简便的方法是 , 其原理是。12. 氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图: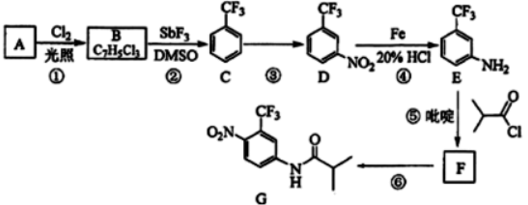
回答下列问题:
(1)、A的结构简式为。C的化学名称是。(2)、③的反应试剂和反应条件分别是 , 该反应的类型是。(3)、⑤的反应方程式为。吡啶是一种有机碱,其作用是。(4)、G的分子式为。(5)、H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有种。(6)、4甲氧基乙酰苯胺( )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(  )制备4甲氧基乙酰苯胺的合成路线 (其他试剂任选)。
)制备4甲氧基乙酰苯胺的合成路线 (其他试剂任选)。