北京市101中学2019-2020学年高三下学期化学第三次月考试卷
试卷更新日期:2021-03-10 类型:月考试卷
一、单选题
-
1. 下列设备工作时,将化学能转化为热能的是( )A、
 硅太阳能电池
B、
硅太阳能电池
B、 锂离子电池
C、
锂离子电池
C、 太阳能集热器
D、
太阳能集热器
D、 燃气灶
2. 化学与社会、生产、生活紧切相关。下列说法正确的是( )A、棉花和木材的主要成分都是纤维素,蚕丝和合成纤维的主要成分都是蛋白质 B、石油干馏可得到石油气、汽油、煤油、柴油等 C、从海水中提取物质都必须通过化学反应才能实现 D、纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污3. 下列化学用语对事实的解释错误的是( )A、NaHS水溶液显碱性:HS-+H2O S2-+H3O+ B、苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3- C、三元催化剂净化汽车尾气中的NO和CO:2NO+2CO 2CO2+N2 D、铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO44.
燃气灶
2. 化学与社会、生产、生活紧切相关。下列说法正确的是( )A、棉花和木材的主要成分都是纤维素,蚕丝和合成纤维的主要成分都是蛋白质 B、石油干馏可得到石油气、汽油、煤油、柴油等 C、从海水中提取物质都必须通过化学反应才能实现 D、纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污3. 下列化学用语对事实的解释错误的是( )A、NaHS水溶液显碱性:HS-+H2O S2-+H3O+ B、苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3- C、三元催化剂净化汽车尾气中的NO和CO:2NO+2CO 2CO2+N2 D、铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO44.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是( )
A、CO和O生成CO2是吸热反应 B、在该过程中,CO断键形成C和O C、CO和O生成了具有极性共价键的CO2 D、状态Ⅰ →状态Ⅲ表示CO与O2反应的过程5. 短周期主族元素X、Y、Z、W的原子序数依次增大,Y+与X2-具有相同的电子层结构,Z与X同族。下列说法正确的是( )A、简单离子的半径:X<Y B、非金属性:Z<W C、氢化物的沸点:X<Z D、氧化物对应水化物的酸性:Z<W6. 某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4 , 其工艺流程如图所示,下列推断合理的是( ) A、向甲中通入CO2可增大c(NH4+)和c(SO42-) B、为提高生产效率,通入的NH3和CO2越多越好 C、颠倒NH3与CO2的加入顺序不影响生产效率 D、最后一步得到(NH4)2SO4固体的操作为蒸干滤液7. 下列根据实验操作和现象得出的结论正确的是( )
A、向甲中通入CO2可增大c(NH4+)和c(SO42-) B、为提高生产效率,通入的NH3和CO2越多越好 C、颠倒NH3与CO2的加入顺序不影响生产效率 D、最后一步得到(NH4)2SO4固体的操作为蒸干滤液7. 下列根据实验操作和现象得出的结论正确的是( )选项
操作及现象
结论
A
酸性高锰酸钾溶液中滴加甲苯后振荡,溶液褪色
甲基对苯环产生影响
B
葡萄糖与新制Cu(OH)2悬浊液共热,产生红色沉淀
葡萄糖是还原性糖
C
在过量的苯酚溶液中滴加少量溴水,未见到白色沉淀
苯酚失效
D
溴乙烷与NaOH的乙醇溶液共热,产生的气体通入酸性KMnO4溶液中,溶液褪色
产生的气体为乙烯
A、A B、B C、C D、D8. 如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3 K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )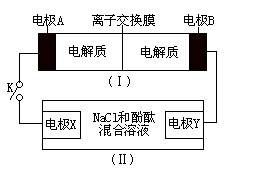 A、K+从右到左通过离子交换膜 B、电极A上发生的反应为:3I--2e-=I3- C、电极X上发生的反应为:2Cl--2e-=Cl2↑ D、当有0.1molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)9. 2019年12月以来,我国部分地区突发的新冠肺炎疫情严重威胁着人们的身体健康。研究发现洛匹那韦对新冠病毒有较好抑制作用,洛匹那韦能溶于水,其结构如图所示,下列说法错误的是( )
A、K+从右到左通过离子交换膜 B、电极A上发生的反应为:3I--2e-=I3- C、电极X上发生的反应为:2Cl--2e-=Cl2↑ D、当有0.1molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)9. 2019年12月以来,我国部分地区突发的新冠肺炎疫情严重威胁着人们的身体健康。研究发现洛匹那韦对新冠病毒有较好抑制作用,洛匹那韦能溶于水,其结构如图所示,下列说法错误的是( )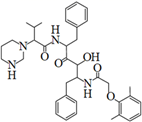 A、洛匹那韦的分子式为C37H48N4O5 B、洛匹那韦能发生取代、加成、消去、氧化、还原反应 C、洛匹那韦的水解产物之一遇Fe3+可显紫色 D、洛匹那韦能溶于水与氢键作用有关10. 25℃时,浓度均为0.1mol·L-1的溶液,其pH如表所示。有关说法正确的是( )
A、洛匹那韦的分子式为C37H48N4O5 B、洛匹那韦能发生取代、加成、消去、氧化、还原反应 C、洛匹那韦的水解产物之一遇Fe3+可显紫色 D、洛匹那韦能溶于水与氢键作用有关10. 25℃时,浓度均为0.1mol·L-1的溶液,其pH如表所示。有关说法正确的是( )序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A、酸性强弱:H2CO3>HF B、①和②中水的电离程度相同 C、离子的总浓度:①>③ D、④中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1mol·L-111. 某同学研究K2Cr2O7溶液中的化学平衡,设计如图所示实验。已知:Cr2O72-+H2O 2CrO42-+2H+△H=+13.8kJ/mol。实验现象如下:i.试管a中溶液为橙色;
ii.试管b中溶液为黄色;
iii.试管c中滴加浓硫酸后温度略有升高,溶液变为深橙色。
下列说法正确的是( )
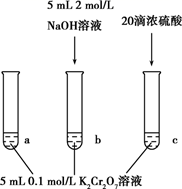 A、该反应是一个氧化还原反应 B、b试管中不存在Cr2O72- C、该实验不能证明减小生成物浓度平衡正向移动 D、试管c中影响平衡的主要因素是温度12. 相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g) 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
A、该反应是一个氧化还原反应 B、b试管中不存在Cr2O72- C、该实验不能证明减小生成物浓度平衡正向移动 D、试管c中影响平衡的主要因素是温度12. 相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g) 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。容器
反应条件
起始物质的量/mol
达到平衡所用时间
/min
达到平衡过程中的能量变化
X2
Y2
XY3
①
恒容
1
3
0
10
放热0.1akJ
②
恒压
1
3
0
t
放热bkJ
下列叙述正确的是( )
A、对于上述反应,①、②中反应的平衡常数K的数值不同 B、①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min) C、②中:X2的平衡转化率小于10% D、b>0.1a13. 资料显示:FeF3溶液接近无色。某同学据此进行以下实验,依据上述实验无法获得的结论是( ) A、FeF3是弱电解质 B、④中发生的离子反应为FeF3+3SCN- Fe(SCN)3+3F- C、相同条件下,结合Fe3+的能力:SCN->F->OH- D、向Fe(SCN)3溶液中加入NaF固体,溶液颜色会变浅14. 生产和实验中广泛采用甲醛法测定饱和食盐水样品中的NH4+含量。利用的反应原理为:4NH4++6HCHO=(CH2)6N4H+(一元酸)+3H++6H2O。实验步骤如下:
A、FeF3是弱电解质 B、④中发生的离子反应为FeF3+3SCN- Fe(SCN)3+3F- C、相同条件下,结合Fe3+的能力:SCN->F->OH- D、向Fe(SCN)3溶液中加入NaF固体,溶液颜色会变浅14. 生产和实验中广泛采用甲醛法测定饱和食盐水样品中的NH4+含量。利用的反应原理为:4NH4++6HCHO=(CH2)6N4H+(一元酸)+3H++6H2O。实验步骤如下:①甲醛中常含有微量甲酸,应先除去。取甲醛amL于锥形瓶,加入1~2滴指示剂,用浓度为bmol/L的NaOH溶液滴定,滴定管的初始读数为V1mL,当锥形瓶内溶液呈微红色时,滴定管的读数为V2mL。
②向锥形瓶加入饱和食盐水试样cmL,静置1分钟。
③用上述滴定管中剩余的NaOH溶液继续滴定锥形瓶内溶液,至溶液呈微红色时,滴定管的读数为V3mL。
下列说法错误的是( )
A、步骤①中的指示剂可以选用酚酞试液 B、步骤②中静置的目的是为了使NH4+和HCHO完全反应 C、步骤②若不静置会导致测定结果偏高 D、饱和食盐水中的c(NH4+)= mol/L二、综合题
-
15.(1)、如图的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。

①下列说法正确的是(填字母序号)
A.固氮过程中,N2只做氧化剂
B.硝化过程需要有氧化剂参与
C.反硝化过程有助于弥补人工固氮对氮循环造成的影响
D.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子。请将该反应的离子方程式补充完整:5CH3OH+□NO3- □( )+□( )+□( )+□( ),
(2)、研究表明,氮氧化物(NOx)和二氧化硫都与大气中雾霾的形成有关。①已知:SO2生成SO3总反应方程式是2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ/mol
此反应可通过如下两步完成:2NO(g)+O2(g) 2NO2(g)ΔH1=-113kJ/mol
NO2(g)+SO2(g) SO3(g)+NO(g)ΔH2=。
②一定温度下,向2L恒容密闭容器中充入NO2和SO2各1mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是。
(3)、砷(As)是第四周期ⅤA族元素,其化合物,有着广泛的用途。①AsH3的稳定性比NH3的稳定性(填“强’’或“弱’’)。用原子结构解释原因。
②常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式。
③298K时,将20mL3xmol•L-1Na3AsO3、20mL3xmol•L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-
 AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)与反应时间(t)的关系如图所示。若平衡时溶液的pH=14,则该反应的平衡常数K为。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)与反应时间(t)的关系如图所示。若平衡时溶液的pH=14,则该反应的平衡常数K为。 16. 含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。(1)、Ⅰ.制取Cu2O
16. 含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。(1)、Ⅰ.制取Cu2O电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是。
(2)、还原法:控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是。(3)、Ⅱ.利用Cu2O光催化处理含Cr2O72-的废水的研究。光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出Cr2O72-转化Cr3+的电极反应:。
 (4)、研究中对Cu2O的作用提出两种假设:
(4)、研究中对Cu2O的作用提出两种假设:a.Cu2O作光催化剂;b.Cu2O与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是2×10-4mol/L,Cr2O72-的初始浓度是1×10-3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是 , 依据是。
 (5)、溶液的pH对Cr2O72-降解率的影响如图所示。
(5)、溶液的pH对Cr2O72-降解率的影响如图所示。
已知:Cu2O
 Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。①pH分别为2、3、4时,Cr2O72-的降解率最好的是 , 其原因是。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是。
17. 合成药物盐酸普罗帕酮的中间体E和双酚A型聚碳酸酯H的路线: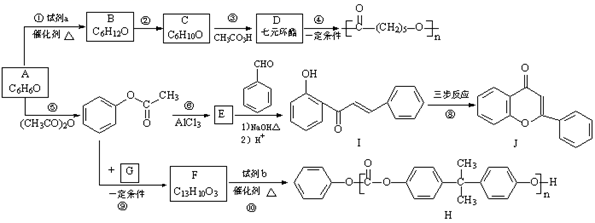
已知:i.
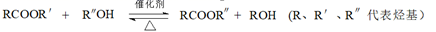
ii.
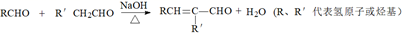 (1)、A的结构简式是。(2)、试剂a是。(3)、C只含有一种官能团,反应②的化学方程式是。(4)、反应⑤的反应类型是。(5)、E中官能团是。(6)、下列说法正确的是:(填字母序号)。
(1)、A的结构简式是。(2)、试剂a是。(3)、C只含有一种官能团,反应②的化学方程式是。(4)、反应⑤的反应类型是。(5)、E中官能团是。(6)、下列说法正确的是:(填字母序号)。a.反应③中C发生氧化反应
b.可用FeCl3溶液检验反应⑤中A是否反应完全
c.反应⑥的反应物与生成物互为同分异构体
d.反应⑩中试剂b的结构简式是

e.反应④是缩合聚合反应,生成了聚酯
(7)、I→J转化的一种路线如图,已知中间产物2转化为J是消去反应,写出中间产物1和中间产物2的结构简式。
中间产物1:;中间产物2:。
(8)、G的分子式为C3H6O3 , 只含一种官能团,且核磁共振氢谱只有一种化学环境的氢,反应⑨的化学方程式是。18. 以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程: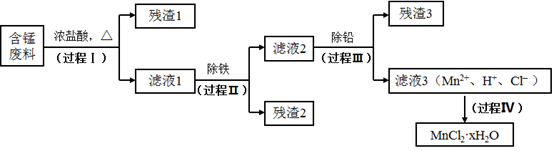
资料a.Mn的金属活动性强于Fe,Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2
Pb(OH)2
Fe(OH)3
开始沉淀时
8.1
6.5
1.9
完全沉淀时
10.1
8.5
3.2
注:金属离子的起始浓度为0.1mol·L-1
(1)、过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。①MnO2与浓盐酸反应的离子方程式是。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入铁氰化钾溶液,无蓝色沉淀生成;另取少量滤液1于试管中,。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.......
写出c的离子方程式:。
(2)、过程Ⅱ的目的是除铁。有如下两种方法:ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物......。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2 , MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在之间。
②补全ⅱ中的操作:。
③两种方法比较,氨水法除铁的缺点是。
(3)、过程Ⅲ的目的是除铅。加入的试剂是。(4)、过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=。19. 实验小组探究KI与Cu(NO3)2的反应,进行实验一:实验一
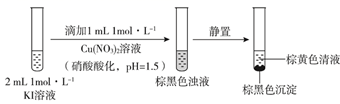
注:本实验忽略Cu2+在此条件下的水解。
(1)、取棕黄色清液,加入少量溶液(试剂a),清液变为色,说明生成了I2。(2)、探究生成I2的原因。①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL溶液(硝酸酸化,pH=1.5),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成I2的原因是酸性条件下, 氧化了I-。
②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除氧化I-的可能性。
③若要确证实验一中是 氧化了I- , 应在实验一的基础上进行检验的实验。
(3)、探究棕黑色沉淀的组成。①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b.吸附I2。为证明上述假设是否成立,取棕黑色沉淀进行实验二:
实验二

已知:CuI难溶于CCl4;I2+ ==2I-+ (无色);Cu++S2O32-== (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
②现象iii为。
③用化学平衡移动原理解释产生现象ii的原因:。