河南省洛阳市洛宁县2019-2020学年九年级下学期化学第三次月考试卷
试卷更新日期:2021-03-09 类型:月考试卷
一、单选题
-
1. 下列物质的性质与用途对应关系错误的是( )A、金刚石硬度大,可制造钻头 B、氮气的化学性质不活泼,常用作保护气 C、铜有良好的导电性,可制作导线 D、氢氧化钠具有碱性,常用于改良酸性土壤2. “拥有天蓝,地绿、水净的美好家园,是每个中国人的梦想”下列做法违背该理念的是()A、多植树造林 B、开发绿色能源 C、焚烧废旧塑料 D、减少煤的燃烧3. 下列实验操作错误的是()A、
 除去O2中的CO2
B、
除去O2中的CO2
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 点燃酒精灯
D、
点燃酒精灯
D、 检查装置的气密性
4. 将呼出的气体与空气相比较,含量明显降低的是()A、稀有气体 B、氧气 C、二氧化碳 D、氮气5. 下列关于水的说法正确的是( )A、液态水变成水蒸气时,水分子变大 B、电解水生成氢气和氧气的体积比为2:1 C、蒸馏或用活性炭吸附均可使海水转化为淡水 D、过滤和加热均能使硬水转化为软水6. 下列有关元素、原子、分子和离子的说法正确的是( )A、微粒得到或失去电子变成离子 B、原子可以构成分子,不能直接构成物质 C、分子是化学变化中的最小微粒 D、与元素化学性质密切相关的是原子的最外层电子数7. 推理是常用的学习方法。下列推理正确的是()A、红磷和木炭都可以在空气中燃烧,所以也可用木炭代替红磷测定空气中 的含量 B、由一种元素组成的纯净物一定是单质,所以单质一定只含有一种元素 C、中和反应生成盐和水,所以有盐和水生成的反应一定是中和反应 D、化学反应通常伴有能量的变化,所以人类利用的能量都是由化学反应提供的8. 如图是两种粒子结构示意图,从图中获得的信息错误的是( )
检查装置的气密性
4. 将呼出的气体与空气相比较,含量明显降低的是()A、稀有气体 B、氧气 C、二氧化碳 D、氮气5. 下列关于水的说法正确的是( )A、液态水变成水蒸气时,水分子变大 B、电解水生成氢气和氧气的体积比为2:1 C、蒸馏或用活性炭吸附均可使海水转化为淡水 D、过滤和加热均能使硬水转化为软水6. 下列有关元素、原子、分子和离子的说法正确的是( )A、微粒得到或失去电子变成离子 B、原子可以构成分子,不能直接构成物质 C、分子是化学变化中的最小微粒 D、与元素化学性质密切相关的是原子的最外层电子数7. 推理是常用的学习方法。下列推理正确的是()A、红磷和木炭都可以在空气中燃烧,所以也可用木炭代替红磷测定空气中 的含量 B、由一种元素组成的纯净物一定是单质,所以单质一定只含有一种元素 C、中和反应生成盐和水,所以有盐和水生成的反应一定是中和反应 D、化学反应通常伴有能量的变化,所以人类利用的能量都是由化学反应提供的8. 如图是两种粒子结构示意图,从图中获得的信息错误的是( ) A、②表示原子 B、①和②不属于同一周期 C、①表示阴离子 D、②易得到6个电子形成稳定结构9. 在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中两个时刻各物质的质量如图所示,图中a、b、c、d分别表示相应物质的质量。下列说法正确的是()
A、②表示原子 B、①和②不属于同一周期 C、①表示阴离子 D、②易得到6个电子形成稳定结构9. 在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中两个时刻各物质的质量如图所示,图中a、b、c、d分别表示相应物质的质量。下列说法正确的是()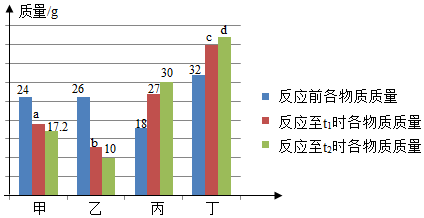 A、b的数值为14 B、该反应为复分解反应 C、反应过程中乙与丁发生改变的质量比为5:6 D、充分反应后生成丙的质量为37.5g10. 电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的电导率变化如图所示。下列说法正确的是( )
A、b的数值为14 B、该反应为复分解反应 C、反应过程中乙与丁发生改变的质量比为5:6 D、充分反应后生成丙的质量为37.5g10. 电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的电导率变化如图所示。下列说法正确的是( ) A、乙曲线电导率减小过程中,溶液由红色变为无色 B、乙曲线对应的反应中四种离子数目都减少 C、甲曲线对应氢氧化钡与硫酸钠反应 D、甲曲线上的M点代表两种溶液恰好完全反应11. 下列实验中,能达到相应目的的是( )A、分离CaO和CaCO3:将固体混合物高温煅烧 B、制备CaCO3:向CaCl₂溶液中通入足量的CO2 , 过滤 C、验证质量守恒定律:将锌粒与稀硫酸混合,比较混合前后溶液的质量 D、除去CO2中混有的HCl和水蒸气:将气体依次通过足量的饱和NaHCO3溶液和浓硫酸12. 下列各组物质的溶液,不用其他试剂,无法将其一一区别的是()A、HCl、Ba(NO3)2、KCl、Na2CO3 B、H2SO4、NaOH、Ba(OH)2、CuSO4 C、BaCl2、Na2SO4、K2CO3、NaNO3 D、HCl、H2SO4、BaCl2、K2CO313. 只含一种杂质的硫酸溶液M,加入足量的氢氧化钡溶液后,再加足量的稀盐酸,过程如图所示。下列判断合理的是( )
A、乙曲线电导率减小过程中,溶液由红色变为无色 B、乙曲线对应的反应中四种离子数目都减少 C、甲曲线对应氢氧化钡与硫酸钠反应 D、甲曲线上的M点代表两种溶液恰好完全反应11. 下列实验中,能达到相应目的的是( )A、分离CaO和CaCO3:将固体混合物高温煅烧 B、制备CaCO3:向CaCl₂溶液中通入足量的CO2 , 过滤 C、验证质量守恒定律:将锌粒与稀硫酸混合,比较混合前后溶液的质量 D、除去CO2中混有的HCl和水蒸气:将气体依次通过足量的饱和NaHCO3溶液和浓硫酸12. 下列各组物质的溶液,不用其他试剂,无法将其一一区别的是()A、HCl、Ba(NO3)2、KCl、Na2CO3 B、H2SO4、NaOH、Ba(OH)2、CuSO4 C、BaCl2、Na2SO4、K2CO3、NaNO3 D、HCl、H2SO4、BaCl2、K2CO313. 只含一种杂质的硫酸溶液M,加入足量的氢氧化钡溶液后,再加足量的稀盐酸,过程如图所示。下列判断合理的是( ) A、M中一定含有碳酸钠 B、图中ab间(不含a、b两点)滴入酚酞溶液变红色 C、bc 段表示沉淀部分消失,有气泡产生 D、d点溶液中的溶质为两种14. 某同学取8gZnO、Al2O3、Cu的混合固体,与73g20%的稀盐酸混合后恰好完全反应,则该混合固体中金属元素的百分含量为( )A、70% B、40% C、30% D、60%
A、M中一定含有碳酸钠 B、图中ab间(不含a、b两点)滴入酚酞溶液变红色 C、bc 段表示沉淀部分消失,有气泡产生 D、d点溶液中的溶质为两种14. 某同学取8gZnO、Al2O3、Cu的混合固体,与73g20%的稀盐酸混合后恰好完全反应,则该混合固体中金属元素的百分含量为( )A、70% B、40% C、30% D、60%二、填空题
-
15. 化学与人类生产、 生活息息相关,请回答下列问题。幼儿及青少年缺元素会患佝偻病和发育不良。冰箱中放入活性炭除异味,利用了活性炭的性。写出一种复合肥的化学式。16. 甲、乙、丙三种固体物质的溶解度曲线如图所示。
 (1)、℃时,甲、丙两种物质的溶解度相等。(2)、t2℃时,等质量的甲、乙、丙配制该温度时的饱和溶液,降温至t1℃,其中所含溶剂质量的大小关系为。(3)、t1℃时,60g 甲的饱和溶液稀释为10%的溶液,需加水的质量为g.17. 以下是某化学反应的微观示意图。
(1)、℃时,甲、丙两种物质的溶解度相等。(2)、t2℃时,等质量的甲、乙、丙配制该温度时的饱和溶液,降温至t1℃,其中所含溶剂质量的大小关系为。(3)、t1℃时,60g 甲的饱和溶液稀释为10%的溶液,需加水的质量为g.17. 以下是某化学反应的微观示意图。 (1)、写出该反应中氧化物的化学式为。(2)、该反应中生成的丙与丁的质量比为。(3)、该反应的化学反应方程式为。18.(1)、某无色气体可能含有H2、CO、CH4中的种或几种,依次进行下列实验(假设每步反应或吸收均完全):
(1)、写出该反应中氧化物的化学式为。(2)、该反应中生成的丙与丁的质量比为。(3)、该反应的化学反应方程式为。18.(1)、某无色气体可能含有H2、CO、CH4中的种或几种,依次进行下列实验(假设每步反应或吸收均完全):①无色气体在足量的氧气中充分燃烧;
②将生成的气体通过盛有浓硫酸的洗气瓶吸收气体中的水蒸气,装置质量增加10.8g;
③再将剩余气体通过盛有足量Ca (OH)2溶液的洗气瓶,装置质量增加13.2g.则该气体的组成情况可能有种 。
(2)、等质量的NaCl、KCl、CaCl2,分别与等质量、等质量分数的硝酸银溶液反应,生成沉淀质量(用各物质化学式表示)的大小关系有以下猜测①NaCl= KCl=CaCl2②CaCl2 =NaCl> KCl③CaCl2> NaCl= KCl④NaCl >CaCl2> KCl,其中正确的是。19. 纯净的二氧化硅是现代光学及光纤制品的基本原料。请回答下列问题:(1)、二氧化硅的化学性质很不活泼,氢氟酸(HF)是唯一可以与之发生反应的酸(生成物为水和四氟化硅气体),该反应的化学方程式为。(2)、二氧化硅与碳酸钙在高温下反应生成硅酸钙( CaSiO3)和二氧化碳:在物质的分类①单质②化合物③氧化物④酸⑤碱⑥盐中,硅酸钙属于(填序号)。20. 实验是实现科学探究的重要途径,请回答下列有关化学实验的问题。 (1)、利用B装置制取种气体,写出有关反应的化学方程式。(2)、实验室可用氯化钠固体和浓硫酸在加热条件下反应制取氯化氢气体,该气体极易溶于水,则制取氯化氢应选择的发生装置和收集装置分别为 (填字母)。
(1)、利用B装置制取种气体,写出有关反应的化学方程式。(2)、实验室可用氯化钠固体和浓硫酸在加热条件下反应制取氯化氢气体,该气体极易溶于水,则制取氯化氢应选择的发生装置和收集装置分别为 (填字母)。三、推断题
-
21. 已知A、B、C、D、E分别为初中化学常见的物质,其中A、B、D、E分别为氧化物、酸、碱、盐中的一种,C是实验室中最常用的溶剂,D广泛用于玻璃、造纸、纺织和洗涤剂的生产,它们的部分反应和转化关系如图所示。(“一”表示两种物质能发生反应,“→”表示一种物质能转化成另一种物质,且省略部分反应物或生成物及反应条件)
 (1)、D的化学式为;(2)、B与D在溶液中发生反应的现象;(3)、写出E→D反应的化学方程式。
(1)、D的化学式为;(2)、B与D在溶液中发生反应的现象;(3)、写出E→D反应的化学方程式。四、简答题
-
22.(1)、写出天然气中最主要成分在空气中燃烧的化学方程式。(2)、目前化石燃料面临耗尽的危险,人们正在开发氢能源,请答出氢能源的优点。23. 已知:铝能与氢氧化钠溶液反应,生成偏铝酸钠(NaAlO2) 和氢气;铁、铜不能与氢氧化钠溶液反应。把上述三种金属样品分别编号为X、Y、Z,若把X、Y、Z分别放入稀硫酸中,则X、Y溶解,Z不溶解,另取X、Y分别放入氢氧化钠溶液中,Y不溶解,X溶解,请回答:(1)、写出铝与氢氧化钠溶液反应的化学方程式。(2)、Y与硝酸银溶液反应后溶液质量如何变化?(3)、描述X与Z的硫酸盐溶液反应的现象。
五、科学探究题
-
24. 有一包白色固体样品,可能含有NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下实验:
步骤I:取少量样品于烧杯中,加足量水,充分搅拌,静置,有固体剩余。
步骤II:取步骤I所得上层清液于试管中,滴入几滴酚酞溶液,溶液变红色;再滴入过量稀盐酸,无气泡产生,红色逐渐褪去,得到无色溶液。
步骤III:取步骤II所得溶液于试管中,滴入过量Ba(NO3)2溶液,无明显现象。
根据上述实验,回答下列问题:
(1)、步骤II中溶液的红色褪去,发生反应的化学方程式是。(2)、分析上述实验过程,关于样品的组成,可以得到的结论是。(3)、若要进一步确定样品的组成,还需进行的实验操作是。25. 学习了生活中常见的盐后,化学实验活动课上,互助合作小组同学们做了如下图所示的三组实验。实验结束后,所有同学将A、B、C三支试管中的废液全部倒入一个干净的大烧杯中,静置一段时间,发现杯底有白色沉底,上层溶液呈红色 。

(提出问题)小明同学提出,大烧杯的上层溶液中除了含有水和酚酞外还含有哪些粒子?
(查阅资料) CaCl2溶液呈中性。
(1)、(猜想假设)经小组讨论后,同学们作了如下猜想:①Na+、Cl- 、CO32-
②Na+、Cl-、OH-
③Na+、Cl-、 CO32-、OH-
④Na+、Cl-、Ca2+、OH-
⑤Na+、Ca2+、 Cl-、CO32-
小明认为猜想不正确,理由是。
(2)、(进行实验)同学们对可能存在的离子进行激烈的讨论,一组同学设计了如下方案,对可能存在的粒子进行探究。实验操作
实验现象
实验结论
取废液少许于试管中,向其中滴加过量的CaCl2溶液
溶液中一定含有CO32-
试管中上层清液仍为红色
溶液中一定含有(写离子符号)
实验中加入过量的CaCl2溶液的目的是。
(3)、(得出结论)猜想正确。(4)、(反思提升)探究废液成分时,需先分析出一定存在和一定不存在的离子,然后再对进行检验。(5)、(拓展延伸)某纯碱样品中含有少量氯化钠杂质。称取该样品22. 8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。计算所得溶液中溶质的质量分数。(写出解题过程,计算结果精确到0. 1%)
-