安徽省宿州市埇桥教育集团安徽省宿州市埇桥教育集团2019-2020学年九年级下学期化学网络月考试卷
试卷更新日期:2021-03-09 类型:月考试卷
一、单选题
-
1. 张聪同学的午餐如下,其中富含蛋白质的食品是( )A、大米饭 B、鱼香肉丝 C、炒白菜 D、油炸花生米2. 下列有关二氧化碳的变化中,只发生物理变化的是( )A、制汽水 B、制“干冰” C、被石灰水吸收 D、参与植物的光合作用3. 有 X、Y、Z 三种金属,将三种金属分别浸入稀硫酸中,Y 溶解并放出氢气,X、Z 不溶, 将 X 浸入 Z 的硝酸盐溶液中,在 X 的表面有 Z 析出,则三种金属的活动性由强到弱的顺序为( )A、X>Y>Z B、Y>X>Z C、Y>Z>X D、X>Z>Y4. 为预防自行车生锈,下列做法中不合理的是( )A、车架表面喷涂油漆 B、钢圈表面镀防护金属 C、链条表面涂机油 D、露天放置,日晒雨淋5. 工业上用氨气(NH3)除去大气污染物中的二氧化氮,其原理用化学方程式表示为:6NO2+8NH3 7X+12H2O,则X的化学式为( )A、N2 B、NO C、N20 D、HNO36. 下列各组物质在溶液中,不能发生复分解反应的是( )A、盐酸和氢氧化钠 B、碳酸钠和稀硫酸 C、氯化钠和氢氧化钾 D、氢氧化钙与碳酸钠7. 只用一种试剂就能把氢氧化钠溶液、稀盐酸和澄清石灰水鉴别开来,这种试剂是( )A、氯化钡溶液 B、碳酸钠溶液 C、酚酞溶液 D、石蕊溶液8. 下列物质中属于复合肥的( )A、KNO3 B、NH4NO3 C、Ca3(PO4)2 D、K2SO49. 有厂商将干粉灭火器的主要成分磷酸二氢铵(NH4H2PO4)从 50%降低到 20%,成为了 安全隐患。磷酸二氢铵是一种白色固体,以下有关说法错误的( )A、磷酸二氢铵难溶于水 B、磷酸二氢铵可以作为一种复合肥 C、与熟石灰混合研磨会产生有刺激性气味的气体 D、高温下磷酸二氢铵分解,在固体表面生成一层玻璃状薄膜覆盖于表面,阻止燃烧进行10. 下列图像不能正确反映其对应变化关系的是( )
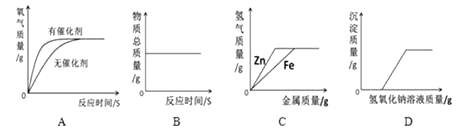 A、用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 B、一定质量的红磷在密闭容器中燃烧 C、向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 D、向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
A、用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 B、一定质量的红磷在密闭容器中燃烧 C、向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 D、向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液二、实验题
-
11. 某同学设计了如下图所示的装置,用于实验室制取CO2并对它的部分性质进行探究,按要求答题。
 (1)、仪器m的名称是 , 图A中发生反应的化学方程式为。(2)、若要图B中的两个气球悬浮在空气中,则气体甲可能是(填序号)。
(1)、仪器m的名称是 , 图A中发生反应的化学方程式为。(2)、若要图B中的两个气球悬浮在空气中,则气体甲可能是(填序号)。a.空气 b.氧气 c.氢气
(3)、往图C中的试管通入CO2 , 当出现现象,表明石灰水中的溶质刚好完全反应。(4)、向图D中的塑料软瓶中倒入一定量的NaOH溶液,迅速拧紧瓶盖,振荡,可观察到瓶子变瘪。若使塑料软瓶恢复原状,可用注射器向瓶中注入过量的(填试剂名称)充分反应即可,反应完成后瓶中溶液的溶质是(填化学式)。三、流程题
-
12. 碳酸亚铁(FeCO3)可用于制作补铁药物,以下是用硫铁矿烧渣(主要成分为Fe2O3、SiO2 等)为原料制备碳酸亚铁的生产流程示意图: 已知 40℃以上,(NH4)2CO3易分解。
 (1)、操作Ⅰ的名称为该操作所用到的玻璃仪器有烧杯、玻璃棒和。(2)、写出向硫铁矿中通入 CO 的化学方程式。(3)、加入(NH4)2CO3后,该反应必须控制的条件是温度。(4)、写出溶液 B 中主要成分的阴离子符号。(5)、从溶液C中可回收一种化工产品(NH4)2SO4 , 请写出它的一种用途用作。
(1)、操作Ⅰ的名称为该操作所用到的玻璃仪器有烧杯、玻璃棒和。(2)、写出向硫铁矿中通入 CO 的化学方程式。(3)、加入(NH4)2CO3后,该反应必须控制的条件是温度。(4)、写出溶液 B 中主要成分的阴离子符号。(5)、从溶液C中可回收一种化工产品(NH4)2SO4 , 请写出它的一种用途用作。四、科学探究题
-
13. 小思同学在实验室用大理石和稀盐酸反应制取二氧化碳完毕后,对废液中溶质 的成分产生了兴趣。请你一同参与探究并回答下列问题:
(提出问题)废液中的溶质是什么物质?
(1)、(作出猜想)小思同学认为废液中溶质只有氯化钙。你认为还可能有的溶质是(填化学式)。(2)、(查阅资料)氯化钙溶液呈中性。(实验与结论)
予以小思同学取少量废液与试管中,滴入几滴无色酚酞试液后,酚酞不变色。于是小 思同学认为自己的猜想是正确的。
②你认为小思同学的实验(填能或不能)证明他的猜想,理由 是。
③如果要证明你的猜想是正确的,你选择的试剂是 , 实验中可 以看到的现象是。
(3)、(拓展与应用)①实验证明你的猜想是正确的。要想处理废液只得到氯化钙溶液,你的实验步骤是。
②通过以上探究, 如果该废液未经处理直接倒入下水道, 可能造成的危害是(写一条)。
14. 某校课外兴趣小组同学对有关镁与盐酸反应的系列研究:(1)、研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:实验时需将镁条进行打磨,其目的是。
(2)、反应中试管外壁发烫,说明镁与稀盐酸反应是反应,化学方程式为。(3)、实验 测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则 t1~t2 时间 内反应速率逐渐加快的主要原因是。 (4)、研究二:探究反应后所得溶液的酸碱性
(4)、研究二:探究反应后所得溶液的酸碱性(发现问题]
①反应后甲同学用 pH 试纸测定试管中溶液的酸碱性,发现 pH 小于 7。
②反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色, 对此现象,乙同学重复如上实验,得到同样结果。
(提出猜想)甲同学:猜想Ⅰ:稀盐酸过量,使溶液 pH 小于 7;
猜想Ⅱ:氯化镁溶液 pH 小于 7. 乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色;
猜想Ⅱ:镁与热水反应使酚酞溶液变红色。
(实践与思考)为验证猜想,甲、乙两同学均需进行一个探究实验是. 乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很 快变为红色,同时还观察到镁条表面有气体生成.该气体能燃烧。请你根据实验现象写 出镁与水反应的化学反应方程式。
(5)、(结论)①镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
②镁与稀盐酸反应,镁过量时所得溶液显碱性。
(交流与反思)氯化钠溶液呈中性,而上述甲同学实验中镁完全反应后所得溶液显酸 性,你认为与溶液中(填离子符号)。
一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,你认为原因可能是 请设计实验验证你的猜想。
五、计算题
-
15. 某化工厂实验室用 10%的氢氧化钠溶液中和一定量的稀盐酸,共消耗氢氧化钠溶液 40克,反应后的溶液呈中性。试计算:(1)、配制 40 克 10%的氢氧化钠溶液,需要水的质量为克。(2)、一定量的盐酸中含 HCl 的质量。(写出过程)
-
-