初中化学人教版一轮复习 考点10 酸碱中和反应与pH
试卷更新日期:2021-03-08 类型:一轮复习
一、单选题
-
1. 下列液体中,酸性最强的是( )A、柠檬汁(pH:2.0-3.0) B、炉具清洁剂(pH:12.0-13.0) C、饮用水(pH:6.5-7.5) D、肥皂液(pH:9.5-10.52. 下列实验操作正确的是( )A、稀释浓硫酸
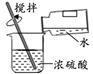 B、取用液体
B、取用液体 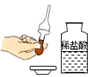 C、测溶液pH
C、测溶液pH 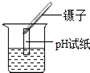 D、读出液体的体积
D、读出液体的体积  3. 与以下三个实验操作相对应的溶液pH变化的图象正确的是( )
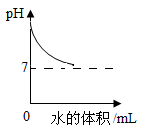
3. 与以下三个实验操作相对应的溶液pH变化的图象正确的是( )①氢氧化钠溶液中加水;②水中加入氢氧化钠溶液;③盐酸中加水。
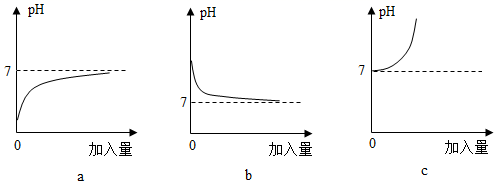 A、a、b、c B、c、a、b C、b、c、a D、a、c、b4. 下列四个图像中,能正确反映对应变化关系的是( )
A、a、b、c B、c、a、b C、b、c、a D、a、c、b4. 下列四个图像中,能正确反映对应变化关系的是( )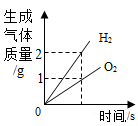
A.用CuFe2O4-x做催化剂,光分解水制氢气与氧气
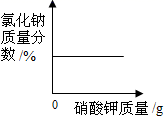
B.向氯化钠的饱和溶液中加入硝酸钾
C.向混有少量硫酸的硫酸铜溶液中加入氢氧化钠溶液
D.向一定质量的碳酸钠溶液中加水
A、A B、B C、C D、D5. 下列反应中属于中和反应的是( )。A、Zn+H2SO4= ZnSO4+H2↑ B、Na2CO3+2HCl=2NaCl+H2O+CO2↑ C、Mg(OH)2+H2SO4=MgSO4+2H2O D、NaCl+AgNO3=AgCl↓+NaNO36. 有资料显示,肉类新鲜程度的变化会引起pH发生相应的变化,变化关系如下表:名称
新鲜肉
次鲜肉
变质肉
pH
5.8~6.2
6.3~6.6
>6.7
则下列分析正确的是( )。
A、肉越新鲜,酸性越弱 B、肉变质过程中,酸性逐渐减弱 C、肉越新鲜,碱性越强 D、肉变质过程中,碱性逐渐减弱7. 如图两幅微观示意图揭示了化学变化的微观实质。相关说法中错误的是( )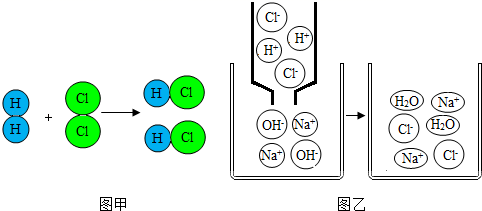 A、图乙说明中和反应的实质是H+和OH﹣反应生成了H2O B、图甲表示的是化合反应 C、图甲表示的反应中元素的化合价没有改变 D、上述两图说明化学反应前后原子的种类、数目都不会发生变化8. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、溶液是均一、稳定的,所以均一、稳定的物质一定是溶液 B、酸性溶液能使紫色石蕊变红,则使紫色石蕊变红的溶液一定呈酸性 C、中和反应有盐和水生成,所以生成盐和水的反应一定是中和反应 D、常温下,碱溶液的pH大于7,碳酸钠溶液的pH也大于7,则碳酸钠属于碱9. 一些物质的近似 pH 如图所示,下列有关说法正确的是( )
A、图乙说明中和反应的实质是H+和OH﹣反应生成了H2O B、图甲表示的是化合反应 C、图甲表示的反应中元素的化合价没有改变 D、上述两图说明化学反应前后原子的种类、数目都不会发生变化8. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、溶液是均一、稳定的,所以均一、稳定的物质一定是溶液 B、酸性溶液能使紫色石蕊变红,则使紫色石蕊变红的溶液一定呈酸性 C、中和反应有盐和水生成,所以生成盐和水的反应一定是中和反应 D、常温下,碱溶液的pH大于7,碳酸钠溶液的pH也大于7,则碳酸钠属于碱9. 一些物质的近似 pH 如图所示,下列有关说法正确的是( ) A、鸡蛋清的碱性比肥皂水的碱性强 B、厕所清洁剂不会腐蚀大理石地面 C、人被蚊虫叮咬后,在肿包处涂抹牛奶就可减轻痛痒 D、厕所清洁剂与炉具清洁剂不能混合使用10. 下列操作和目的都正确的是( )
A、鸡蛋清的碱性比肥皂水的碱性强 B、厕所清洁剂不会腐蚀大理石地面 C、人被蚊虫叮咬后,在肿包处涂抹牛奶就可减轻痛痒 D、厕所清洁剂与炉具清洁剂不能混合使用10. 下列操作和目的都正确的是( )选项
操作
目的
A
将一小片pH试纸润湿后放在玻璃片上,用玻璃棒蘸取少量待测液滴在试纸上
测定某溶液的pH
B
CO还原Fe2O3时,先通CO,后加热
防止发生爆炸
C
先将胶头滴管挤压,再伸入试剂瓶中吸取液体
保证滴管的胶头部分也充满液体
D
将水沿烧杯壁缓缓注入盛有浓硫酸的烧杯里,用玻璃棒不断搅拌
稀释浓硫酸
A、A B、B C、C D、D11. 河道两旁甲乙两厂,它们排放的工业废水中共含H+、Na+、Ba2+、Cl-、SO42-、CO32-六种离子。两厂废水中各含三种离子,其中甲厂的废水明显呈酸性,甲废水中的离子是( )A、H+、Na+、Ba2+ B、H+、Ba2+、Cl- C、Na+、SO42-、CO32- D、H+、SO42-、CO32-12. “关爱生命,注意安全,拥抱健康”是人类永恒的主题。下列叙述正确的是( )A、甲状腺肿大是由缺铁引起的 B、人体内血浆的正常pH范围是0.9-1.5;如果出现异常,则可能导致疾病 C、大量吸烟能使人中毒死亡,青少年一定不要吸烟 D、汽车尾气中含有一氧化碳、二氧化碳、二氧化硫等空气污染物,会危害人体健康13. 生活中一些常见食物的pH如下:食物
柠檬汁
鸡蛋清
纯水
牛奶
红豆汁
pH
2.0-2.5
7.4~7.6
7
6.3-8.5
10.2-11.4
上述食物中,胃酸过多的人不宜食用的是( )
A、柠檬汁 B、牛奶 C、鸡蛋 D、红豆汁14. 室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸的容器中,边滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图。下列相关叙述错误的是( ) A、容器中发生的反应属于中和反应 B、a点溶液能使紫色石蕊溶液变红 C、b点表示HCl与NaOH等质量反应 D、c点溶液中的溶质是NaCl和NaOH15. 小莉同学用稀盐酸和氢氧化钠溶液对酸碱中和反应进行了如下探究,用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器测得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。下列说法错误的是()
A、容器中发生的反应属于中和反应 B、a点溶液能使紫色石蕊溶液变红 C、b点表示HCl与NaOH等质量反应 D、c点溶液中的溶质是NaCl和NaOH15. 小莉同学用稀盐酸和氢氧化钠溶液对酸碱中和反应进行了如下探究,用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器测得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。下列说法错误的是() A、该实验是将氢氧化钠溶液滴入盐酸中 B、据图三说明中和反应是放热反应 C、图二中的A点反应程度与图三中的B点对应 D、C点对应溶液中溶质成分是NaCl和NaOH
A、该实验是将氢氧化钠溶液滴入盐酸中 B、据图三说明中和反应是放热反应 C、图二中的A点反应程度与图三中的B点对应 D、C点对应溶液中溶质成分是NaCl和NaOH二、填空题
-
16. H2SO4是一种重要的化工原料。(1)、H2SO4溶液的pH7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法。(2)、浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是(填写序号)。
①H2
②CO2
③NH3
④HCl
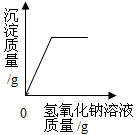
(3)、实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2 , 请写出该反应的化学方程式:。(4)、向160g含有H2SO4和CuSO4的混合溶液中逐滴加入NaOH溶液至过量,产生的沉淀质量与加入NaOH溶液质量的关系如图所示,请写出b点对应溶液的溶质(填写化学式),原混合溶液中CuSO4的质量分数是。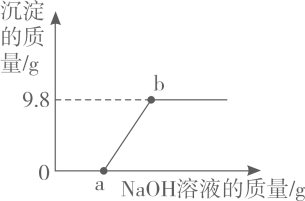 17. “宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方式。(1)、“
17. “宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方式。(1)、“ ”表示碳原子,“
”表示碳原子,“  ”表示氧原子。“
”表示氧原子。“  ”化学式为; (2)、①图1中,“Fe”表示多种信息,如表示铁元素、铁单质,还能表示;
”化学式为; (2)、①图1中,“Fe”表示多种信息,如表示铁元素、铁单质,还能表示;
②观察图2和图3中微粒变化的共同点,可以得出酸碱中和反应的微观实质是;
(3)、图4表示稀盐酸(左)稀硫酸(右)参加反应,图5表示将氯化钡溶液滴入稀硫酸中至恰好完全反应,反应前后溶液中存在的主要离子图4中不能体现酸的通性的是(填字母序号);写出图5中图形代表的离子(填粒子符号): 。
。 
三、综合题
-
18. 某废酸液主要含H2SO4和FeSO4 , 研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如下:
 (1)、该废酸液的pH7(填“<”或“>”)。操作Ⅰ的名称为。(2)、电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。(3)、“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是和(填化学式)。(4)、磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为。(5)、研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为。pH较低时产率较低的主要原因是。
(1)、该废酸液的pH7(填“<”或“>”)。操作Ⅰ的名称为。(2)、电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。(3)、“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是和(填化学式)。(4)、磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为。(5)、研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为。pH较低时产率较低的主要原因是。溶液的pH
6.0
6.5
7.0
7.5
8.0
9.0
产物颜色
黄褐色
黄褐色
较黑
很黑
很黑
灰黑色
产率(%)
43.9
50.6
86.2
93.0
92.3
91.6
四、实验探究题
-
19. 中和反应是化学核心概念之一。某化学兴趣小组对中和反应展开了探究。
(实验目的)证明氢氧化钠溶液与盐酸发生化学反应。
(实验步骤)
步骤一:取一定量稀氢氧化钠溶液于烧杯中,滴加2滴酚酞试液,溶液呈红色。
步骤二:用仪器A吸取稀盐酸向烧杯中逐滴加入,边滴加边用玻璃棒搅拌,红色变浅直至消失。
步骤三:向溶液中继续滴加稀盐酸至溶液呈酸性,用玻璃棒蘸取其中溶液,在酒精灯上加热至蒸干,有白色固体产生。
(1)、(思考拓展)从下列仪器中选择步骤二中的“仪器A”,名称是。
 (2)、兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。
(2)、兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。查阅资料:(i)酚酞试液在不同的pH时变化情况如下:
pH
0~8.2
8.2~10.0
10.0~14.0
颜色
无色
粉红色
红色
(ⅱ)氢氧化钠溶液的pH随浓度的降低而减小。
兴趣小组据此形成了对比实验方案以排除干扰,该对比实验方案是。
(3)、为确认步骤三中的白色固体是氯化钠而不是氢氧化钠,进行如下实验:步骤
现象
结论
将白色固体溶于水形成溶液,均分成两等份
向其中一份滴加CuSO4溶液,振荡、静置
①无色沉淀生成
白色固体不是NaOH。
向另一份滴加AgNO3溶液,振荡、静置
出现白色沉淀
②白色固体是NaCl,反应的化学方程式为。
(4)、(继续探究)如图1是氢氧化钠与盐酸反应的微观示意图。从微观角度分析,氢氧化钠溶液和盐酸反应的实质是。
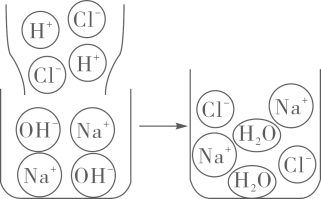 (5)、兴趣小组认为上述实验对反应实质缺少直观的验证。
(5)、兴趣小组认为上述实验对反应实质缺少直观的验证。査阅资料:(ⅲ)变色硅胶为蓝色,吸水后呈红色。(ⅳ)变色硅胶与NaOH固体充分混合,无明显现象;变色硅胶与无水醋酸(CH3COOH)充分混合,无明显现象。
兴趣小组据此设计了如图实验,验证中和反应有水生成:将无水醋酸迅速倒入装有NaOH固体和变色硅胶的试管中,并用玻璃棒在试管中不断搅拌,观察到变色硅胶由蓝色逐渐变为红色,U型管内液面左低右高。

①U型管内液面左低右高说明该反应热量(填写“放出”或“吸收”)。
②无水醋酸由CH3COO-和H+构成。变色硅胶由蓝色变成红色的原因是(用化学方程式表示)。
20. 某兴趣小组发现某块土地玉米长势不好,为探究其原因,开启了项目学习之旅。(查阅资料)玉米适宜在pH为6.0~7.0的土壤中生长;植物生长需要多种营养元素,包括碳、氢、氧、氮、磷、钾、钙、镁等大量元素和其他微量元素。
(任务一)检测土壤的酸碱度并制定改良方案
(1)、检测该地土壤的酸碱度可选用的实验用品:精密pH试纸(可精确到0.1)、标准比色卡、pH计、其他自选
实验步骤
测量结果
实验结论
步骤一:将3份不同位置的土样,干燥后分别与自来水按2:5的质量比在不同的烧杯中混合,充分搅拌后静置;
试样一:pH=4.2
试样二:pH=4.4
试样三:pH=4.5
该土壤pH<6.0,不适合玉米生长
步骤二:。
反思与评价:该实验方法有一处不够严密,请指出并说明原因。
(2)、探究熟石灰对土样酸碱性的改变情况实验方法:取300g土样和g蒸馏水混合,向其中加入一定量熟石灰,充分搅拌后静置,用pH计测定清液的pH;
测量结果:清液的pH为12.1;
反思:若要使改良的土壤适合玉米生长,需控制加入熟石灰的量。
(3)、熟石灰用量的测定实验目的:研究使300g土样呈中性所需的熟石灰的质量
实验方法:。
(4)、查阅资料,常用的酸性土壤改良剂有:生石灰、熟石灰、草木灰(主要成分K2CO3)、含钙的贝壳灰(主要成分CaCO3);要使改良后土壤的pH约为7,也可加入稍过量的(从上述改良剂中选择)。(任务二)分析土壤肥力
通过观察,该土地上玉米叶色略有发黄,且有倒伏现象;该小组同学建议施加适量含氮元素和钾元素的复合肥,如。
五、计算题
-
21. 用73g的稀盐酸和10%的氢氧化钠溶液进行反应实验时,反应过程中溶液的酸碱度变化如下图所示(反应的化学方程式 )。
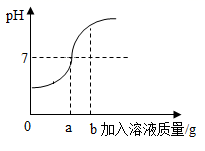 (1)、该实验是将(选填稀盐酸或氢氧化钠溶液)滴加到另一种溶液中。(2)、当加入溶液的质量为b时,此时溶液中的溶质是(填化学式)。(3)、当加入溶液的质量a为40g时,求所得溶液中溶质的质量分数。(结果精确到0.1%)
(1)、该实验是将(选填稀盐酸或氢氧化钠溶液)滴加到另一种溶液中。(2)、当加入溶液的质量为b时,此时溶液中的溶质是(填化学式)。(3)、当加入溶液的质量a为40g时,求所得溶液中溶质的质量分数。(结果精确到0.1%)
-