初中化学沪教版(上海)九年级下学期 第6单元测试卷
试卷更新日期:2021-03-06 类型:单元试卷
一、单选题
-
1. 下列成都出土的文物中,不属于金属材料的是( )A、东汉说唱俑
 B、“郫”字青铜戈
B、“郫”字青铜戈  C、龙纹铅饼币
C、龙纹铅饼币  D、黄金面具
D、黄金面具  2. 多数合金与组成成分相比较,合金的( )A、熔点高,硬度小 B、密度大 C、性能差 D、熔点低,硬度大3. 化把对提高农作物的产量具有重要作用。下列化属于复合肥料的是( )A、CO(NH2)2 B、(NH4)2 HPO4 C、K2SO4 D、Ca(H2 PO4)24. 用以下装置进行CO还原CuO的实验,下列说法正确的是( )
2. 多数合金与组成成分相比较,合金的( )A、熔点高,硬度小 B、密度大 C、性能差 D、熔点低,硬度大3. 化把对提高农作物的产量具有重要作用。下列化属于复合肥料的是( )A、CO(NH2)2 B、(NH4)2 HPO4 C、K2SO4 D、Ca(H2 PO4)24. 用以下装置进行CO还原CuO的实验,下列说法正确的是( )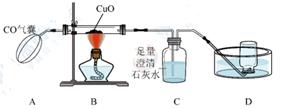 A、实验时先点燃酒精灯,再挤压CO气囊 B、澄清石灰水可用于检验并吸收CO2气体 C、实验中B处的现象为红色物质逐渐变黑 D、实验结束后直接将热的Cu倒出,对实验无影响5. 下列有关化肥的说法正确的是( )A、硝酸铵是一种复合肥 B、施用化肥不会造成环境污染 C、碳酸氢铵可以和碱性物质混合施用 D、硫酸铵和尿素[化学式是CO(NH2)2]可以用熟石灰鉴别6. 某学习小组同学做完铁与稀硫酸反应实验后,将反应后的混合物M全部倒入盛有一小块铜锌合金的烧杯中,发现有大量气泡产生。待充分反应后过滤,得到滤液和滤渣。他们得出的现象或结论如下:①M中一定不含铁单质;②烧杯中溶液由浅绿色变成蓝色;③滤液中一定含有ZnSO4;④滤渣中可能含有三种金属单质;⑤滤液中可能含有两种金属离子。其中正确的个数有:( )A、4个 B、3个 C、2个 D、1个7. 现有一包由2.4g镁、6.5g锌、1.6g碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,反应结束后,经过滤、洗涤、干燥,测得滤渣含有三种物质。则滤渣的质量可能是( )A、10.5g B、35.6g C、44.8g D、45.8g8. 黄铜的颜色与黄金相似,在生活中常常误认为黄金。兴趣小组为探究某黄铜(铜锌合金)中锌的含量,向10.0g该黄铜中加稀硫酸,测得实验数据如图所示。以下分析错误的是( )
A、实验时先点燃酒精灯,再挤压CO气囊 B、澄清石灰水可用于检验并吸收CO2气体 C、实验中B处的现象为红色物质逐渐变黑 D、实验结束后直接将热的Cu倒出,对实验无影响5. 下列有关化肥的说法正确的是( )A、硝酸铵是一种复合肥 B、施用化肥不会造成环境污染 C、碳酸氢铵可以和碱性物质混合施用 D、硫酸铵和尿素[化学式是CO(NH2)2]可以用熟石灰鉴别6. 某学习小组同学做完铁与稀硫酸反应实验后,将反应后的混合物M全部倒入盛有一小块铜锌合金的烧杯中,发现有大量气泡产生。待充分反应后过滤,得到滤液和滤渣。他们得出的现象或结论如下:①M中一定不含铁单质;②烧杯中溶液由浅绿色变成蓝色;③滤液中一定含有ZnSO4;④滤渣中可能含有三种金属单质;⑤滤液中可能含有两种金属离子。其中正确的个数有:( )A、4个 B、3个 C、2个 D、1个7. 现有一包由2.4g镁、6.5g锌、1.6g碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,反应结束后,经过滤、洗涤、干燥,测得滤渣含有三种物质。则滤渣的质量可能是( )A、10.5g B、35.6g C、44.8g D、45.8g8. 黄铜的颜色与黄金相似,在生活中常常误认为黄金。兴趣小组为探究某黄铜(铜锌合金)中锌的含量,向10.0g该黄铜中加稀硫酸,测得实验数据如图所示。以下分析错误的是( ) A、a点时,锌有剩余 B、c点时,硫酸没有完全参与反应 C、该黄铜中锌的质量分数为44% D、所用稀硫酸的溶质质量分数为8.29%9. 下列各组物质在水中能大量共存,且形成无色透明溶液的是( )A、CuSO4、KCl、HCl B、K2SO4、NaOH、NH4Cl C、HNO3、NaCl、Ca(OH)2 D、KNO3、Na2SO4、NaCl10. 下列图像能正确反映其对应关系的是( )。A、向氢氧化钠溶液中加水,稀释
A、a点时,锌有剩余 B、c点时,硫酸没有完全参与反应 C、该黄铜中锌的质量分数为44% D、所用稀硫酸的溶质质量分数为8.29%9. 下列各组物质在水中能大量共存,且形成无色透明溶液的是( )A、CuSO4、KCl、HCl B、K2SO4、NaOH、NH4Cl C、HNO3、NaCl、Ca(OH)2 D、KNO3、Na2SO4、NaCl10. 下列图像能正确反映其对应关系的是( )。A、向氢氧化钠溶液中加水,稀释 B、浓硫酸敞口放置一段时间
B、浓硫酸敞口放置一段时间  C、向饱和石灰水中加入少量生石灰
C、向饱和石灰水中加入少量生石灰  D、MnO2对过氧化氢溶液分解的影响
D、MnO2对过氧化氢溶液分解的影响  11. A~H都是初三化学前四个单元中的常见物质,B为黑色粉末,C、D在常温时均呈液态,B在反应①和③中前后质量和化学性质均不变,下列说法合理的是( )
11. A~H都是初三化学前四个单元中的常见物质,B为黑色粉末,C、D在常温时均呈液态,B在反应①和③中前后质量和化学性质均不变,下列说法合理的是( ) A、推测物质B为二氧化锰,C和D,E和F两组物质组成元素相同 B、反应②这个实验中,生成G和H两种气体的质量比约为2:1 C、A在H中燃烧后生成的黑色固体是Fe2O3 D、该图中共发生了3个分解反应12. 区分下列各组物质的两种方法都正确的是( )
A、推测物质B为二氧化锰,C和D,E和F两组物质组成元素相同 B、反应②这个实验中,生成G和H两种气体的质量比约为2:1 C、A在H中燃烧后生成的黑色固体是Fe2O3 D、该图中共发生了3个分解反应12. 区分下列各组物质的两种方法都正确的是( )选项
A
B
C
D
区分的物质
氢氧化钠和硝酸铵
饱和的硝酸钾溶液和饱和的澄清石灰水
铁粉和木炭粉
黄金和黄铜
方法一
观察颜色
升高温度
分别与稀盐酸混合
加热后观察颜色
方法二
加入水中观察
通入二氧化碳
观察颜色
加氯化镁溶液
A、A B、B C、C D、D二、填空题
-
13. 将一定量的Zn粉和Cu粉投入到硝酸银溶液中,充分反应后过滤,得到滤渣和蓝色滤液,则滤渣中可能含有 , 滤液中一定含有的溶质是;请用化学方程式解释溶液变蓝的原因。14. 纽扣电池是生活中常用的电源,下图是银锌纽扣电池的构造示意图,回答下列问题。
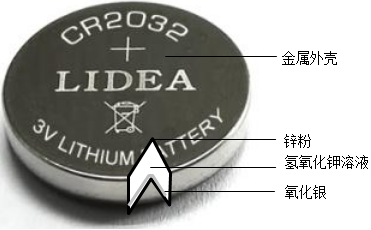 (1)、纽扣电池的外壳可以加工得很薄,说明金属具有性。(2)、氧化银加热分解可以得到两种单质,其化学反应方程式为。(3)、该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是 , 为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是(填序号)。
(1)、纽扣电池的外壳可以加工得很薄,说明金属具有性。(2)、氧化银加热分解可以得到两种单质,其化学反应方程式为。(3)、该电池中涉及的铁、锌、银三种金属,它们的金属活动性由强到弱的顺序是 , 为了验证该结论,某同学向质量、外形相同的铁片、锌片、银片中分别加入足量15%的稀盐酸,以下现象中不能成为该结论证据的是(填序号)。A、表面没有气泡生成
B、铁表面最终生成气体的总量比锌多
C、铁表面产生气泡的速率比锌慢
三、综合题
-
15. 人类的生产、生活离不开金属。(1)、下列生活用品主要是由金属材料制成的是(填字母)。
 (2)、锂是最轻的金属,是制造电池的理想物质,锂离子电池是新一代可充电的绿色电池。如图是锂原子的结构示意图,在化学反应中,锂原子容易(填“得到”或“失去”)电子形成锂离子,锂离子的化学符号为。
(2)、锂是最轻的金属,是制造电池的理想物质,锂离子电池是新一代可充电的绿色电池。如图是锂原子的结构示意图,在化学反应中,锂原子容易(填“得到”或“失去”)电子形成锂离子,锂离子的化学符号为。 (3)、沈阳地铁的修建使用了大量的钢铁。工业上用赤铁矿(主要成分是Fe2O3)和一氧化碳反应冶炼铁,写出该反应的化学方程式:。由氧化铁变成铁时,铁元素化合价的具体变化是。(4)、金属的应用与金属活动性密切相关。利用下列提供的试剂,设计可行的实验方案验证铁、铜的金属活动性强弱。现有试剂:铁片、铜片、硫酸铜溶液、稀硫酸。(金属均已打磨)
(3)、沈阳地铁的修建使用了大量的钢铁。工业上用赤铁矿(主要成分是Fe2O3)和一氧化碳反应冶炼铁,写出该反应的化学方程式:。由氧化铁变成铁时,铁元素化合价的具体变化是。(4)、金属的应用与金属活动性密切相关。利用下列提供的试剂,设计可行的实验方案验证铁、铜的金属活动性强弱。现有试剂:铁片、铜片、硫酸铜溶液、稀硫酸。(金属均已打磨)实验操作
实验现象
实验结论
铁的金属活动性比铜强
16. 金属材料广泛应用于生产、生活中。(1)、用铜作导线,利用了铜的延展性和性。(2)、镁是一种活泼的金属,请写出镁与稀盐酸反应的化学方程式。(3)、将等质量的A、B、C三种金属(生成物中金属元素均为+2价),分别放入质量分数相等且足量的稀盐酸中,产生H2的质量与反应时间的关系如图所示。A、B、C三种金属中,金属活动性由强到弱的顺序是 , 相对原子质量最大的是。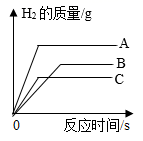 (4)、向一定量的硝酸银和硝酸亚铁混合溶液中加入mg锌粉,充分反应后过滤,得到滤液和滤渣。下列分析正确的是(填字母序号)。
(4)、向一定量的硝酸银和硝酸亚铁混合溶液中加入mg锌粉,充分反应后过滤,得到滤液和滤渣。下列分析正确的是(填字母序号)。A若滤渣只含一种金属,则滤液中的溶质只有三种
B若滤液中含有两种金属离子,则滤渣中的固体只有两种
C若最终得到的滤渣质量仍为mg,则滤液中溶质最多有两种
D若向滤渣中加入稀盐酸,有气泡产生,则滤液中的溶质最多有两种
17. 同学们做了如下实验,回答下列问题: (1)、写出实验一的化学方程式 , 实验二的现象是。(2)、在实验三中,同学们利用酚酞验证盐酸与氢氧化钠溶液能发生化学反应,则加入酚酞的步骤在“逐滴滴加过量盐酸”的。
(1)、写出实验一的化学方程式 , 实验二的现象是。(2)、在实验三中,同学们利用酚酞验证盐酸与氢氧化钠溶液能发生化学反应,则加入酚酞的步骤在“逐滴滴加过量盐酸”的。A 前面
B 后面
C 前后均可
18. 已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,A在高温煅烧的条件下生成一种金属氧化物和非金属氧化物,B为氧化物;D、E、F三种物质含有同种非金属元素,其中F是黑色固体单质,E是易与血液中血红蛋白结合的有毒气体。它们之间的转化关系如图所示(有些转换关系,反应条件等略去)。试回答: (1)、写出F的化学式:;(2)、写出D物质的一种用途。(3)、用化学方程式表示以下转换关系:A→D , 该反应的反应类型。(4)、E→D反应过程(填“放出”或“吸收”)热量。19. 已知A、B、C、D、E是初中化学中常见的五种物质。其中A、D是黑色固体,D具有磁性,B、C、E是无色气体,B的相对分子质量小于C,它们在一定条件下的转化关系如图所示(其他反应物和生成物己略去)。请回答下列问题:
(1)、写出F的化学式:;(2)、写出D物质的一种用途。(3)、用化学方程式表示以下转换关系:A→D , 该反应的反应类型。(4)、E→D反应过程(填“放出”或“吸收”)热量。19. 已知A、B、C、D、E是初中化学中常见的五种物质。其中A、D是黑色固体,D具有磁性,B、C、E是无色气体,B的相对分子质量小于C,它们在一定条件下的转化关系如图所示(其他反应物和生成物己略去)。请回答下列问题:
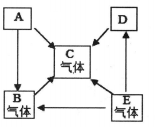 (1)、C是(填化学式)﹔(2)、写出E转化成D的化学方程式(3)、写出B在高温条件下还原D的化学方程式(4)、评述B物质的“利”与“弊”(各举一例)20. 实验室常会产生含硫酸的废水,需经处理至中性.某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水.(1)、定性检测废水
(1)、C是(填化学式)﹔(2)、写出E转化成D的化学方程式(3)、写出B在高温条件下还原D的化学方程式(4)、评述B物质的“利”与“弊”(各举一例)20. 实验室常会产生含硫酸的废水,需经处理至中性.某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水.(1)、定性检测废水检测废水呈酸性的方法是 .
(2)、配制200g质量分数为5.6%的氢氧化钾溶液①计算
m(KOH)= g,V(H2O) mL(水的密度近似为1.0g•mL﹣1).
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量.然后 (按操作先后顺序,填字母),直至天平平衡.
A .向烧杯中加氢氧化钾固体 B .按需要添加砝码、移动游码
C .量取; D .溶解 E .转移.
(3)、定量测定废水取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示.(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)

①P点对应溶液中一定存在的阳离子有 (填离子符号).
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%).
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.1%).
四、实验探究题
-
21. 小组同学收集某种铝易拉罐,剪成条状并打磨后做如图实验,发现纯铝片有划痕。
 (1)、[发现问题]根据所学知识,合金的硬度比组成它的纯金属硬度更 , 结合上述现象,可得出该易拉罐不是纯铝制作,那么易拉罐中除了铝外,还含有什么金属呢?(2)、[查阅资料] ①铝易拉罐的主要成分是铝,可能含有镁、铁。
(1)、[发现问题]根据所学知识,合金的硬度比组成它的纯金属硬度更 , 结合上述现象,可得出该易拉罐不是纯铝制作,那么易拉罐中除了铝外,还含有什么金属呢?(2)、[查阅资料] ①铝易拉罐的主要成分是铝,可能含有镁、铁。②铝能与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;镁和铁不能与氢氧化钠溶液反应。
[进行猜想]该易拉罐的金属组成除铝外,还可能含有镁、铁中的一种或两种。
[设计实验]小明取打磨后的铝易拉罐样品按如下方案进行实验。
实验步骤
实验现象
解释与结论
①取一定量的样品于烧杯中,加入足量的溶液,充分反应后,过滤、洗涤、干燥。
固体表面有大量气泡产生;过滤后得到大量黑色粉末。
样品中含有铝。
②取少量上述黑色粉末于试管中,加入足量的稀盐酸。
有大量气泡产生,溶液变成浅绿色。
样品中含有镁和铁。铁发生反应的化学方程式为
[实验结论]小明得出该易拉罐是由铝镁和铁组成。
(3)、[反思评价]其他同学分析后认为小明的实验方案不严密,理由;大家认为应该补充下列实验:取实验①中少量黑色粉末于试管中,加入含NO3—的溶液时,黑色粉末中金属表面的质量变化如图,并看到溶液颜色发生明显变化。则加入溶液的名称是溶液,则小明的实验结论正确。 (4)、[拓展应用]哈尔滨市正在推行“城市生活垃圾分类”工作,你认为废弃的易拉罐应放入标有图标的垃圾桶内。
(4)、[拓展应用]哈尔滨市正在推行“城市生活垃圾分类”工作,你认为废弃的易拉罐应放入标有图标的垃圾桶内。 22. 甲同学设计了如图实验装置验证一氧化碳的部分性质并验证产物。实验时,在点燃B处酒精灯之前先通一氧化碳排除装置中的空气,然后继续实验。
22. 甲同学设计了如图实验装置验证一氧化碳的部分性质并验证产物。实验时,在点燃B处酒精灯之前先通一氧化碳排除装置中的空气,然后继续实验。 (1)、B中反应的化学方程式是 , 该反应的还原剂是。(2)、实验过程中,C中的现象是 , 反应的化学方程式是。D处点燃的目的是。(3)、对该实验的分析正确的是(选填编号)。
(1)、B中反应的化学方程式是 , 该反应的还原剂是。(2)、实验过程中,C中的现象是 , 反应的化学方程式是。D处点燃的目的是。(3)、对该实验的分析正确的是(选填编号)。a 实验结束时应先熄灭B处酒精灯;
b C中增加的质量与B中固体减小的质量相等;
c 反应结束后继续通入一氧化碳的目的是防止铜被氧化。
(4)、甲同学认为A装置用于证明一氧化碳不能和石灰水反应,乙同学认为省略A可达到同样的目的,理由是。23. 现有铁、铝、铜、稀盐酸、硫酸铜溶液,某同学想通过实验探究Fe、Al、Cu三种金属活动性顺序,请你一起参与并回答下列问题: (1)、通过A、B两个实验能说明铝的金属活动性比铁强,判断的依据是。(2)、根据D实验得出结论:铝的金属活动性比铜强,实验时观察到的现象是;C实验发生反应的化学反应方程式为。(3)、经讨论,同学们一致认为可以去掉其中的两个实验,同样能够得出Fe、Al、Cu三种金属活动性顺序。这样既节约药品,又节约实验时间。可以去掉的两实验是(填字母)。(4)、假设C试管中两种物质恰好完全反应,D试管中铝过量,将C、D试管反应后的物质倒入同一个烧杯中充分反应后,搅拌,过滤,所得的滤渣中一定含有(填化学式)。24. 某校化学兴趣小组的同学学习了酸、碱、盐的知识后,对课本中“酸、碱、盐之间并不是都能发生复分解反应”这句话产生了兴趣,展开了探究性学习。
(1)、通过A、B两个实验能说明铝的金属活动性比铁强,判断的依据是。(2)、根据D实验得出结论:铝的金属活动性比铜强,实验时观察到的现象是;C实验发生反应的化学反应方程式为。(3)、经讨论,同学们一致认为可以去掉其中的两个实验,同样能够得出Fe、Al、Cu三种金属活动性顺序。这样既节约药品,又节约实验时间。可以去掉的两实验是(填字母)。(4)、假设C试管中两种物质恰好完全反应,D试管中铝过量,将C、D试管反应后的物质倒入同一个烧杯中充分反应后,搅拌,过滤,所得的滤渣中一定含有(填化学式)。24. 某校化学兴趣小组的同学学习了酸、碱、盐的知识后,对课本中“酸、碱、盐之间并不是都能发生复分解反应”这句话产生了兴趣,展开了探究性学习。(提出问题)发生复分解反应应具备哪些条件?
(1)、(活动探究)该小组同学进行以下四组实验,发现均能反应,写出④的化学方程式:。①硝酸钡溶液与稀硫酸
②稀硫酸与碳酸钾溶液
③稀盐酸与氢氧化钠溶液
④硝酸钡溶液与碳酸钾
(2)、(理论分析)上述反应为什么能够发生?是因为在这些反应物的溶液中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水。如:①中有 ;
②中有 ;
③中有 ;
④中有两种离子,所以才发生化学反应。
(3)、(得出结论)经过分析,该小组同学得出以下结论:生成物中是否有沉淀或气体或 , 是判断酸、碱、盐之间能否发生复分解反应的主要条件。(4)、(形成网络)按照一定的顺序排列某些离子,就可以形成一种知识网络。在网络中,用“-”相连接的阴、阳离子间能两两结合生成沉淀或气体或水。现有 、 两种离子,请将它们填入下面合适的“ ”内,使其形成一个更为完整的复分解反应的知识网络。
”内,使其形成一个更为完整的复分解反应的知识网络。 
五、计算题
-
25. 取一定量铜粉、铁粉的混合物,加入过量稀硫酸,完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显+2价)。固体质量与各步实验的时间关系如图。
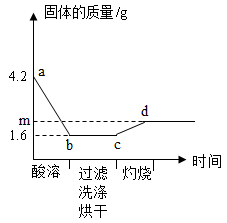 (1)、b点时溶液中溶质的化学式为。(2)、原粉状混合物中铁粉的质量为多少克。(3)、求m的值。(写出计算过程)
(1)、b点时溶液中溶质的化学式为。(2)、原粉状混合物中铁粉的质量为多少克。(3)、求m的值。(写出计算过程)