初中化学沪教版(上海)九年级下学期 第6单元 6.1 奇光异彩的金属
试卷更新日期:2021-03-06 类型:同步测试
一、单选题
-
1. 下列说法中正确的是( )A、只含有一种元素的物质一定是单质 B、能导电的单质一定是金属 C、氧化物中一定含有氧元素 D、有发光放热现象的变化一定是燃烧2. 同学们对金属N的活动性进行探究发现:将金属N放入稀盐酸中,有气泡产生(生成NCl2),将金属N放入ZnSO4溶液中无明显变化。下列化学方程式书写错误的是( )A、 B、 C、 D、3. 根据下图所示实验,下列说法错误的是( )
 A、因为加了网罩,所以不用给试管预热 B、实验结束,若立即倒出粉末则红色粉末变黑 C、石灰水变浑浊,说明有二氧化碳生成 D、本实验说明木炭具有还原性4. 向含有FeSO4和CuSO4的混合溶液中加入一定质量的Zn粒,充分反应后过滤,再向滤渣中加入稀硫酸,有气泡产生,根据上述现象,得出的结论正确的是( )。A、滤渣中只有Cu B、滤渣中一定有Fe C、滤渣中一定有Zn D、滤渣中一定有Cu、Fe、Zn5. 某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况进行了如下实验:取等质量的X、Y、Z分别与足量浓度相同的稀硫酸反应,都生成+2价的金属硫酸盐,反应情况如图所示。下列对该图像的理解正确的是( )。
A、因为加了网罩,所以不用给试管预热 B、实验结束,若立即倒出粉末则红色粉末变黑 C、石灰水变浑浊,说明有二氧化碳生成 D、本实验说明木炭具有还原性4. 向含有FeSO4和CuSO4的混合溶液中加入一定质量的Zn粒,充分反应后过滤,再向滤渣中加入稀硫酸,有气泡产生,根据上述现象,得出的结论正确的是( )。A、滤渣中只有Cu B、滤渣中一定有Fe C、滤渣中一定有Zn D、滤渣中一定有Cu、Fe、Zn5. 某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况进行了如下实验:取等质量的X、Y、Z分别与足量浓度相同的稀硫酸反应,都生成+2价的金属硫酸盐,反应情况如图所示。下列对该图像的理解正确的是( )。 A、相对原子质量:X>Y>Z B、金属活动性由强到弱:X>Z>Y C、金属活动性由强到弱:X>Y>Z D、X、Y、Z可能依次是Mg、Zn、Fe6. 实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌)取100g黄铜样品粉末于烧杯中,先加300g稀硫酸,充分反应后过滤得滤液为318.9g,再向滤渣继续滴加相同浓度的稀硫酸至不再产生气泡为止,此时所用稀硫酸的量恰好为100g,则黄铜样品中锌的质量分数为( )A、26% B、19.5% C、13% D、74%7. 有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是( )A、丙<丁<甲<乙 B、乙<甲<丁<丙 C、丁<甲<乙<丙 D、丙< 乙<甲<丁8. 在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。综合以上信息得到以下结论,合理的是( )
A、相对原子质量:X>Y>Z B、金属活动性由强到弱:X>Z>Y C、金属活动性由强到弱:X>Y>Z D、X、Y、Z可能依次是Mg、Zn、Fe6. 实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌)取100g黄铜样品粉末于烧杯中,先加300g稀硫酸,充分反应后过滤得滤液为318.9g,再向滤渣继续滴加相同浓度的稀硫酸至不再产生气泡为止,此时所用稀硫酸的量恰好为100g,则黄铜样品中锌的质量分数为( )A、26% B、19.5% C、13% D、74%7. 有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是( )A、丙<丁<甲<乙 B、乙<甲<丁<丙 C、丁<甲<乙<丙 D、丙< 乙<甲<丁8. 在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。综合以上信息得到以下结论,合理的是( )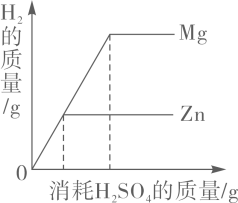 A、从图象可以看出,金属镁比金属锌的活动性强 B、若两种金属都有剩余,二者得到的氢气质量相同 C、若硫酸有剩余,二者得到氢气的质量相同 D、若两种金属完全溶解,二者消耗硫酸的质量相同9. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是( )
A、从图象可以看出,金属镁比金属锌的活动性强 B、若两种金属都有剩余,二者得到的氢气质量相同 C、若硫酸有剩余,二者得到氢气的质量相同 D、若两种金属完全溶解,二者消耗硫酸的质量相同9. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是( )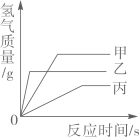 A、完全反应所需时间:丙>甲>乙 B、生成氢气的质量:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙10. 验证铝、铜、银的金属活动性强弱,小明设计了以下四组实验,下列说法错误的是( )
A、完全反应所需时间:丙>甲>乙 B、生成氢气的质量:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙10. 验证铝、铜、银的金属活动性强弱,小明设计了以下四组实验,下列说法错误的是( )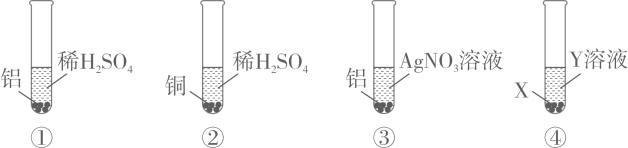 A、通过①②实验,可以证明金属活动性Al>Cu B、通过①②③实验,可以证明金属活动性Al>Cu>Ag C、若要用实验④证明金属活动性Al>Cu,X可以为Al,Y为CuSO4溶液 D、若要用实验④证明金属活动性Cu>Ag,X可以为Cu,Y为AgNO3溶液
A、通过①②实验,可以证明金属活动性Al>Cu B、通过①②③实验,可以证明金属活动性Al>Cu>Ag C、若要用实验④证明金属活动性Al>Cu,X可以为Al,Y为CuSO4溶液 D、若要用实验④证明金属活动性Cu>Ag,X可以为Cu,Y为AgNO3溶液二、填空题
-
11. 铝、铜、铁是生活中常见的金属。(1)、铝在空气中具有很好的抗腐蚀性能的原因是。(2)、用铜制作导线主要是利用铜具有良好的性;(3)、焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,反应的化学方程式为。12. 我国夏商时期工匠们就掌握成熟的炼铜技术。如图为实验室模拟炼铜的两种装置。

①图 A 中生成铜的化学方程式是。实验过程中,先通一段时间CO,再加热的原因是 , 末端的酒精灯的作用是。
②取用炭粉和氧化铜的仪器是。图 B 实验结束时,若先停止加热,后移出导管,产生的后果是。
③上述两种实验方法,都利用了CO和C的性。
④上述两种实验方法,你认为“图A”或“图B”哪个实验方法更好,你的理由是。
13. 铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。(1)、人类冶炼和使用金属铝的时间较晚。可能是因为(填字母)。a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)、用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和(写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式:。(3)、用砂纸去除铝片表面的氧化膜,将其浸人硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。①写出生成红色物质的化学方程式:。
②硫酸铜溶液中的阳离子有(填离子符号)。
(4)、原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由13个铝原子构成,其最外层电子数的总和为40时相对稳定。写出该稳定铝原子簇的微粒符号:。(铝原子的结构示意图为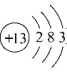 )
) 三、综合题
-
14. 为防止水体污染并回收金属,某工厂向含有硫酸铜和硫酸镁的废水中加入一定量的锌粉,充分反应后过滤得固体和滤液,取少量固体,向其中滴加稀盐酸,请回答下列问题:(1)、若有气泡产生,则滤液中一定含有的溶质是(写化学式),产生气泡的反应的化学方程式为。(2)、若无气泡产生,则滤液中一定含有的溶质是(写化学式),废水中发生反应的化学方程式为。15. 金属材料被大量应用于工农业生产和其他领域。请回答:(1)、金属的物理性质的应用
下列金属的用途利用金属导热性的是(填字母)。
a.铜制电线
b.铁制铁锅
c.金制项链
d.铝制饮料罐
(2)、金属的化学性质的应用。①铝制品耐腐蚀的原因是
②实验室制取氢气的反应原理是(用化学方程式表示),所选用装置的连接顺序为(填端口序号)。

③将锌放人硝酸银与硝酸铜的混合溶液中,造成溶液质量减轻的化学反应为(用化学方程式表示)。若反应后溶液呈无色,则反应后溶液中溶质的化学式为。
(3)、金属的获得①湿法冶炼
“曾青(CuSO4)得铁则化为铜”所属的基本反应类型是。
(4)、②电解法冶炼工业上利用电解熔融的氧化铝得到铝和氧气,写出该反应的化学方程式。
③加热分解金属氧化物
“加热氧化汞可得到金属汞”,请用微粒观分析此反应过程。
(5)、④还原金属氧化物用2000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少吨(结果保留小数点后一位)?
方法1. 根据化学方程式计算。
方法2.利用化学式进行计算。
16. 从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示: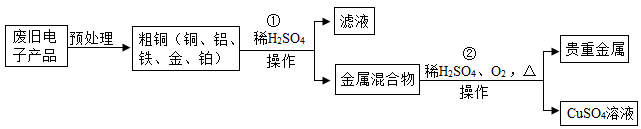 (1)、图中“操作”的名称是 。(2)、写出所得贵重金属中任意一种成分的化学式。(3)、写出①中发生的化学反应方程式(任写一种);该反应的基本类型为 。(4)、写出②中发生的化学反应方程式。17. 某工厂排放的废水中含有硫酸铜,将废水处理可得到铜和氧化铁两种产品。过程如下图所示:
(1)、图中“操作”的名称是 。(2)、写出所得贵重金属中任意一种成分的化学式。(3)、写出①中发生的化学反应方程式(任写一种);该反应的基本类型为 。(4)、写出②中发生的化学反应方程式。17. 某工厂排放的废水中含有硫酸铜,将废水处理可得到铜和氧化铁两种产品。过程如下图所示: (1)、过程①中发生反应的化学反应方程式为。(2)、过程②中发生反应的化学反应方程式为。(3)、加入过量A的作用是。(4)、产品F和G分别是。
(1)、过程①中发生反应的化学反应方程式为。(2)、过程②中发生反应的化学反应方程式为。(3)、加入过量A的作用是。(4)、产品F和G分别是。四、计算题
-
18. 为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次
第2次
第3次
第4次
第5次
滴入稀硫酸的质量/g
25
25
25
25
25
生成气体的总质量/g
0.05
m
0.15
0.20
0.20
请完成下列问题:
(1)、表中m的值为;(2)、银、锌合金中银的质量分数为;(3)、所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)