初中化学鲁教版九年级下学期 第九单元第二节 金属的化学性质
试卷更新日期:2021-03-06 类型:同步测试
一、单选题
-
1. 下列关于金属材料的说法中,不正确的是( )A、生铁、硬铝、焊锡都属于合金 B、铜有良好的导电性,因而大量用于制作电线 C、铝表而易生成致密氧化铝薄膜,因而具有很好的抗腐蚀性 D、锈蚀后的铁制品没有回收价值2. 做完一氧化碳还原氧化铁的实验后,试管壁上会留下一层黑色物质。可选用的清洗方法为( )A、用大量水边冲边洗 B、用稀盐酸清洗后再用水冲洗 C、用试管刷上下、左右猛烈刷洗 D、用肥皂水清洗后再用水冲洗3. 向CuSO4溶液中加入一定质量的Al粉,充分反应后过滤,得蓝色滤液,并将滤渣晾干(不考虑操作中的损失)。下列说法正确的是( )A、滤液中只含有Al2(SO4)3 B、滤渣的质量等于Al粉的质量 C、向滤渣中滴加稀盐酸,无气泡产生 D、发生反应的化学方程式为Al+CuSO4=Cu+Al2(SO4)34. 现有甲、乙、丙三种金属,如果把甲和乙分别放入稀硫酸中,甲溶解并产生H2。乙不反应:如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙的表面有银析出,而丙没有变化,根据以上事实,则甲、乙、丙的金属活动性由强到弱的顺序是( )A、甲>乙>丙 B、乙>甲>丙 C、乙>丙>甲 D、丙>乙>甲5. X、Y、Z是三种二价金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )。
①Z+YSO4=ZSO4+Y;
②X+YSO4=XSO4+Y;
③Z+H2SO4=ZSO4+H2↑;
④X+H2SO4→不发生反应。
A、Z>X>Y B、X>Y>Z C、Z>Y>X D、X>Z>Y6. 为了验证铁、锌、铜三种金属的活动性顺序,设计了如下四种方案,其中可行的是( )。A、将Zn、Cu分别加入到FeSO4溶液中 B、将Zn、Fe分别加入到CuSO4溶液中 C、将Zn分别加入到FeSO4、CuSO4溶液中 D、将Cu分别加入到ZnSO4、FeSO4溶液中7. 下列反应属于置换反应的是( )。①C+O2 CO2;②CO2+C 2CO;
③Zn+2HCl=ZnCl2+H2↑;④3CO+Fe2O3 2Fe+3CO2;⑤Fe+CuSO4=Cu+FeSO4。
A、①④ B、②③ C、③⑤ D、②④8. 等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图像能正确表示产生氢气质量与反应时间之间关系的是( )A、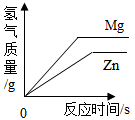 B、
B、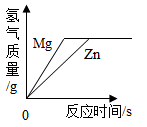 C、
C、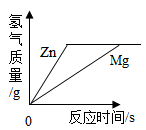 D、
D、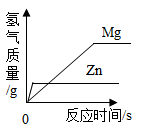 9. 取等质量的X、Y、Z三种金属分别与足量同浓度的稀盐酸反应,都生成+2价盐,反应情况如图,以下叙述正确的是( )
9. 取等质量的X、Y、Z三种金属分别与足量同浓度的稀盐酸反应,都生成+2价盐,反应情况如图,以下叙述正确的是( )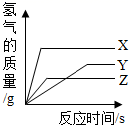 A、金属活动性由强到弱:X>Y>Z B、产生氢气质量:X>Y>Z C、X、Y、Z依次可能是Mg、Zn、Fe D、反应所需时间:X<Y<Z10. 等质量的M、N两种金属,分别与足量稀盐酸反应,生成氢气质量和反应应时间的关系如图所示,下列说法正确的是( )
A、金属活动性由强到弱:X>Y>Z B、产生氢气质量:X>Y>Z C、X、Y、Z依次可能是Mg、Zn、Fe D、反应所需时间:X<Y<Z10. 等质量的M、N两种金属,分别与足量稀盐酸反应,生成氢气质量和反应应时间的关系如图所示,下列说法正确的是( ) A、N的金属活动性比M强 B、N生成氢气质量比M多 C、如果N是铁,M可能是镁 D、N产生氢气的速率更快
A、N的金属活动性比M强 B、N生成氢气质量比M多 C、如果N是铁,M可能是镁 D、N产生氢气的速率更快二、综合题
-
11. 回答下列与金属有关的问题。(1)、用铜作导线,利用了它的延展性和性;(2)、铝制品耐腐蚀,因为铝制品表面有一层致密的氧化物薄膜,其化学式为;(3)、生铁片与纯铁片相互刻画时,纯铁片表面可留下划痕,说明的硬度大;(4)、使用下列各组试剂,通过适当操作,能验证Fe、Cu、Ag活动性顺序的是 。A、Ag、FeSO4溶液 、CuSO4溶液 B、Fe 、Cu 、AgNO3溶液 C、Fe 、Ag 、CuSO4溶液12. 进行如图所示微型实验,研究物质的性质。
 (1)、能发生反应的是(填字母序号)。(2)、若要验证铁、铜、银的金属活动性顺序,依据的现象是 , 反应的化学方程式为。(3)、在锌、铁、铜、银中,通过该实验,无法比较金属活动性顺序的两种金属是。13. 某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分井回收金属,取样品进行如图实验:
(1)、能发生反应的是(填字母序号)。(2)、若要验证铁、铜、银的金属活动性顺序,依据的现象是 , 反应的化学方程式为。(3)、在锌、铁、铜、银中,通过该实验,无法比较金属活动性顺序的两种金属是。13. 某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分井回收金属,取样品进行如图实验: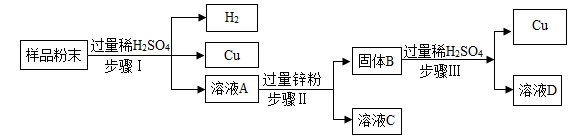 (1)、步骤Ⅱ的操作是。(2)、步骤Ⅱ中产生的现象是。(3)、若溶液C中只含一种溶质,则样品的成分是。14. 某化学兴趣小组的同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验。
(1)、步骤Ⅱ的操作是。(2)、步骤Ⅱ中产生的现象是。(3)、若溶液C中只含一种溶质,则样品的成分是。14. 某化学兴趣小组的同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验。 (1)、试管乙中观察到的现象是 , 发生反应的化学方程式为 。(2)、同学们经过讨论后认为该方案可以优化,试管的实验是多余的。同学们经过讨论得出三种金属的活动性由强到弱的顺序为。
(1)、试管乙中观察到的现象是 , 发生反应的化学方程式为 。(2)、同学们经过讨论后认为该方案可以优化,试管的实验是多余的。同学们经过讨论得出三种金属的活动性由强到弱的顺序为。三、实验探究题
-
15. 学习金属的化学性质时,小亮同学将一称重后的铜片伸入盛有AgNO3溶液的烧杯中,待溶液颜色变蓝后,取出铜片直接称量,发现其质量增加了ag
请回答:
(1)、写出上述反应的化学方程式。(2)、取出铜片后,烧杯内的溶液质量减少了g。(3)、小健同学将一定量的铁粉加入取出铜片后的溶液中,充分振荡后过滤,向滤渣中加入稀硫酸,有气泡生成。则可推断,滤液中的溶质是。16. 一般情况下,金属活动性越强,与酸反应的速度越快。为了探究金属镁、锌、铁与酸反应的快慢,某研究性学习小组设计了如下的实验。(实验步骤)
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸。
②分别将过量的、颗粒大小相同的镁、锌、铁三种金属粉末,放入相同的气球中。
③小心的把三个气球分别套在各个试管口上,如图所示。
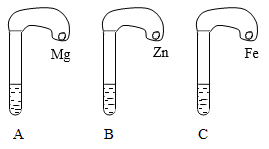
④分别将三种金属粉末倒入试管中。
(实验预测与分析)
(1)、写出锌与盐酸反应的化学方程式。(2)、气球膨胀最快的是。(填“A或B或C”)(3)、铁粉与盐酸反应的现象是。(4)、步骤④是实验获得成功的关键,你认为该操作应该注意的是:。17. 某课外小组的同学以“铁、铜、银的化学性质”为课题,进行科学探究活动,请根据已学知识完成下列探究问题。(提出问题)铁、铜、银的金属活动性顺序是怎样的?
(1)、(猜想和假设)根据所学知识,猜想三种金属在金属活动顺序中的相对位置关系:猜想一:Ag Fe Cu;
猜想二:Fe Cu Ag;
猜想三:
 (2)、(制定计划)甲同学设计的实验如图所示。他们在实验中都进行了规范的操作和细致的观察。
(2)、(制定计划)甲同学设计的实验如图所示。他们在实验中都进行了规范的操作和细致的观察。(收集证据)你认为实验①中应观察到的现象是
(3)、(解释与结论)乙同学认为甲同学的实验设计有不正确,其理由是(4)、(反思)反思后甲同学对自己的实验进行了改正,其作法是由此证明了探究三者的金属活动性顺序活动中猜想正确。
18. 化学知识能够破解某些骗局。骗子常用金光闪闪的“假金元宝”(Cu-Zn合金制成)冒充真金,蒙骗贪小便宣之人。“圳创”小组进行了真假元宝的鉴别。(1)、定性鉴别。下列方法中不能检验金元宝真假的是(填字母,可多选);A.观察外观
B.检测其密度
C.放入MgCl2溶液中
D.在空气中加热
(2)、定量测定。取40g“假金元宝”样品,磨成粉末放入烧杯,将150g一定浓度的稀硫酸分3次加入烧杯中,每次充分反应后,测得剩余固体的质量记录如下表。次数 1 2 3 加入稀硫酸质量/g 50 50 50 剩余固体质量/g 34.8 29.6 27.0 ①第二次实验后剩余29.6g固体的成分是(填字母);
A.CuB. Zn
C.Cu和Zn
②样品中Cu的质量分数为%;
(3)、反应一共生成H2的质量是多少?(写出详细计算过程)(4)、请在下图中绘制出“产生H2的质量”跟“加入稀硫酸的质量”的关系图像。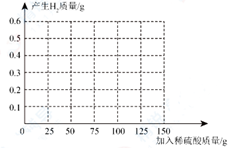
四、计算题
-
19. 欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。(1)、你认为能测出铜的质量分数的是。(2)、取该合金的粉末26g加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如下图所示。

①生成气体的质量为g;
②试计算该合金中铜的质量分数。
20. 许多电子元件中都使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:第一次
第二次
第三次
第四次
加入稀硫酸的质量(g)
20
20
20
20
烧杯中剩余物的质量(g)
39.92
59.84
79.80
99.80
产生氢气的总质量(g)
0.08
0.16
0.20
m
(1)、兴趣小组同学发现:电子元件中的黄铜较难研磨成粉末,原因之一是黄铜合金的硬度比组成它的纯金属硬度(填“大”或“小”)。(2)、黄铜合金中的铜不能与稀硫酸发生反应,原因是。(3)、兴趣小组同学发现:生成氢气的质量既可通过实验测定获得,也可通过计算获得。计算方法是:所加稀硫酸总质量加上黄铜质量,最后减去烧杯中剩余物质的质量,计算的依据是定律。(4)、黄铜粉末完全反应生成氢气的总质量,即m值为g。(5)、该黄铜中铜的质量分数为多少? (写出计算过程)