华师大版初中科学九年级下学期3.1 物质的转化(一)
试卷更新日期:2021-03-05 类型:同步测试
一、夯实基础
-
1. 下列物质不能使金属生成金属氧化物的是( )A、氧气 B、浓硫酸 C、稀硫酸 D、硝酸2. 要除去二氧化碳中混有的少量一氧化碳,可以采用的方法是将混合气体( )A、通过澄清石灰水 B、通过灼热的木炭 C、通过水 D、通过灼热的氧化铜3. 在浓硫酸的运输过程中,能将浓硫酸盛放在铁制的容器中。其原因是( )A、铁的化学性质稳定,不与硫酸反应 B、铁与浓硫酸反应生成致密的氧化物 C、铁与浓硫酸反应生成FeSO4保护层 D、铁与浓硫酸反应生成Fe2(SO4)3保护层4. 在氢气还原氧化铜的实验中,观察到的现象是( )A、有红色的铜生成 B、试管口有水生成 C、有铜和水生成 D、黑色固体变成红色,试管口有水珠生成5. 如图是CO与Fe2O3反应的实验装置图,下列说法不正确的( )
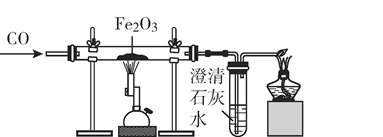 A、实验开始时,先通入CO,在装置出口处验纯后,点燃酒精灯,再点燃酒精喷灯 B、实验过程中看到,玻璃管里的粉末由红棕色逐渐变为黑色 C、CO与Fe2O3反应的化学方程式为Fe2O3 + CO 2Fe+CO2 D、尾气处理时发生反应的化学方程式为2CO+O2 2CO26. 木炭与氧化铜、一氧化碳与氧化铜反应的实验装置分别如图所示,下列说法正确的是( )
A、实验开始时,先通入CO,在装置出口处验纯后,点燃酒精灯,再点燃酒精喷灯 B、实验过程中看到,玻璃管里的粉末由红棕色逐渐变为黑色 C、CO与Fe2O3反应的化学方程式为Fe2O3 + CO 2Fe+CO2 D、尾气处理时发生反应的化学方程式为2CO+O2 2CO26. 木炭与氧化铜、一氧化碳与氧化铜反应的实验装置分别如图所示,下列说法正确的是( ) A、一氧化碳与氧化铜的反应中A的作用是尾气处理 B、木炭、一氧化碳与氧化铜的反应中,都只有碳元素的化合价发生了变化 C、两个实验中都可以观察到红色固体变黑 D、木炭、一氧化碳与氧化铜的反应都属于置换反应7. 将含有CO、H2、N2、CO2的混合气体,依次通过灼热的CuO粉末(足量)、澄清石灰水(足量)和浓H2SO4 , 假设每一步都反应完全,最后剩下的气体是( )A、N2、CO2 B、N2 C、N2、H2O D、N2、CO8. 如图将插入橡胶塞的一根光亮的红色铜丝绕成螺旋状,在酒精灯的火焰上烧一段时间后趁热迅速伸入盛有澄清石灰水和X气体的集气瓶中,塞紧橡胶塞,看到变黑色的铜丝又变为红色,同时澄清石灰水变浑浊,则集气瓶中的气体X是( )
A、一氧化碳与氧化铜的反应中A的作用是尾气处理 B、木炭、一氧化碳与氧化铜的反应中,都只有碳元素的化合价发生了变化 C、两个实验中都可以观察到红色固体变黑 D、木炭、一氧化碳与氧化铜的反应都属于置换反应7. 将含有CO、H2、N2、CO2的混合气体,依次通过灼热的CuO粉末(足量)、澄清石灰水(足量)和浓H2SO4 , 假设每一步都反应完全,最后剩下的气体是( )A、N2、CO2 B、N2 C、N2、H2O D、N2、CO8. 如图将插入橡胶塞的一根光亮的红色铜丝绕成螺旋状,在酒精灯的火焰上烧一段时间后趁热迅速伸入盛有澄清石灰水和X气体的集气瓶中,塞紧橡胶塞,看到变黑色的铜丝又变为红色,同时澄清石灰水变浑浊,则集气瓶中的气体X是( ) A、H2 B、O2 C、CO D、CO2
A、H2 B、O2 C、CO D、CO2二、能力提升
-
9. 工业上可用如下反应制取金属钡:2Al+4BaO 3Ba↑+Ba(AlO2)2。则下列说法正确的是( )A、反应物铝能被磁铁吸引 B、生成物Ba(AlO2)2属于氧化物 C、反应前后铝元素的化合价发生改变 D、该反应属于复分解反应10. 用氢气还原氧化铜,实验操作有以下几步:a.加热装有氧化铜的试管;b.通入验纯后的氢气;c.实验结束撤去酒精灯;d.继续通入氢气至试管冷却。正确的操作顺序是( )A、a、b、c、d B、b、a、c、d C、a、b、d、c D、b、a、d、c11. 某同学实验时,用氢气还原16g氧化铜,反应一段时间后,停止加热,冷却后称量剩余固体质量为14.4g,则下列结论正确的是( )A、有1.6g水生成 B、有1.4g铜生成 C、实际用去氢气的质量大于0.2g D、有80%的氧化铜参加反应12. 将CO通入盛有12g Fe2O3的试管内,加热反应一段时间后,停止加热,继续通入CO至试管冷却,此时试管内残留固体的质量为9.6g,则反应生成铁的质量为( )A、2.4g B、5.6g C、8.4g D、9.6g13. 某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种。为确认其组成,某同学取一定量该气体按如图所示装置进行实验(假设每一步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,装置④增重2.2g。下列关于气体X成分的分析中,错误的是( )
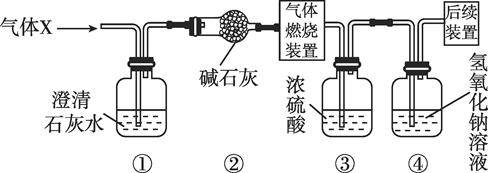
小资料:碱石灰的主要成分是氧化钙和氢氧化钠
A、一定没有二氧化碳 B、可能含有甲烷和氢气 C、可能只有甲烷 D、可能含有氢气和一氧化碳14. 如图是初中科学中常见的一些氧化物和单质之间的相互转化关系。其中单质Ⅰ为红色固体,氧化物Ⅰ和单质Ⅲ均为黑色固体,氧化物Ⅲ能使澄清石灰水变浑浊。则: (1)、反应①中(填化学式)被还原。(2)、氧化物Ⅱ除图中所示的化学性质外,还具有性,对人体有危害。(3)、根据题意,写出反应④的化学方程式:。
(1)、反应①中(填化学式)被还原。(2)、氧化物Ⅱ除图中所示的化学性质外,还具有性,对人体有危害。(3)、根据题意,写出反应④的化学方程式:。三、拓展创新
-
15. 兴趣小组对“一氧化碳还原氧化铁”的实验进行拓展研究。
【查阅资料】Ⅰ.MgCO3+Zn MgO+ZnO+CO↑
Ⅱ.用氯化亚铜溶液吸收CO时,产生红色固体:2CuCl + 2CO+2H2O=Cu2Cl2(CO)2·2H2O↓
【设计方案】根据上述资料设计如图实验装置(固定装置略,装置气密性好):

【实验步骤】①打开弹簧夹,通入适量氮气;②关闭弹簧夹,点燃A、B两处酒精灯;③观察实验现象;④熄灭两只酒精灯。
【实验分析】
(1)、步骤①的目的是。(2)、步骤③时,B处玻璃管中红棕色粉末变黑,该反应的化学方程为 , C处现象是 , D处出现红色固体。(3)、下列关于该实验的说法正确的是____。A、B处固体质量逐渐减小 B、D处现象证明A,B处发生了反应 C、必须在E处加一只点燃的酒精灯 D、步骤④后,应继续通氮气至玻璃管冷却(4)、已知A处参加反应的MgCO3质量为1.68g,C处得到沉淀质量为1g。从环保角度考虑D中CuCl质量最少需g。16. 小金利用如图装置进行甲、乙对比实验,探究温度对CO和 Fe2O3反应的影响(固定装置略)。 (1)、从实验安全角度考虑,图示装置还应采取的改进措施是。(2)、完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
(1)、从实验安全角度考虑,图示装置还应采取的改进措施是。(2)、完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:步骤
操作
甲组现象
乙组现象
1
称量黑色粉末质量/g
m1
m2
2
取黑色粉末,用磁铁吸引
能被吸引
能被吸引
3
取黑色粉末,加入稀盐酸
全部溶解,有大量气泡
无明显现象
4
取黑色粉末,加入足量CuSO4溶液
有红色物质生成
无明显现象
①甲组的黑色粉末与稀盐酸反应的化学方程式是。
②小金查阅资料后发现Fe3O4在常温下不与稀盐酸、CuSO4溶液反应,故猜想乙组的生成物为 Fe3O4。他又发现m2恰好为g,这可成为支持上述猜想的新证据。
(3)、甲、乙两组实验说明温度对CO和Fe2O3反应有影响,且均体现出CO的(填写化学性质)。