北京市房山区2020-2021学年九年级上学期化学期末考试试卷
试卷更新日期:2021-03-04 类型:期末考试
一、单选题
-
1. 空气中氮气的体积分数约为( )A、21% B、0.94% C、0.03% D、78%2. “富硒大米”具有较高的营养价值,其中的“硒”是指( )A、硒原子 B、硒分子 C、硒元素 D、硒单质3. 下列物质中,含有金属元素的是( )A、CO2 B、H2O C、P2O5 D、Fe3O44. 下列物质放入水中,能形成溶液的是( )A、面粉 B、食盐 C、香油 D、大米5. 下列仪器,可直接加热的是( )A、
 B、
B、 C、
C、 D、
D、 6. 下列物质由离子构成的是( )A、水 B、铁 C、氧气 D、氯化钠7. 下列符号能表示2个氧原子的是( )A、2O2 B、O2 C、2O D、2O2-8. 下列化学式书写正确的是( )A、氧化镁MgO2 B、氧化铁FeO C、氢氧化钠NaOH D、硫酸铝AlSO49. 如图是地壳中元素含量分布示意图,能表示氧元素的是( )
6. 下列物质由离子构成的是( )A、水 B、铁 C、氧气 D、氯化钠7. 下列符号能表示2个氧原子的是( )A、2O2 B、O2 C、2O D、2O2-8. 下列化学式书写正确的是( )A、氧化镁MgO2 B、氧化铁FeO C、氢氧化钠NaOH D、硫酸铝AlSO49. 如图是地壳中元素含量分布示意图,能表示氧元素的是( )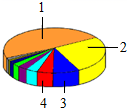 A、1 B、2 C、3 D、410. 下列物质的性质中,属于化学性质的是( )A、液氧是淡蓝色液体 B、碳酸不稳定 C、二氧化碳比空气的密度大 D、石墨具有导电性11. 下列物质属于氧化物的是( )A、O2 B、NaCl C、CaO D、Ca(OH)212. 炒菜时油锅起火,可用锅盖盖灭,其灭火原理是()A、清除可燃物 B、隔绝空气 C、降低油的着火点 D、防止油溅出13. 面条是我国的传统食品。下列烹制面条的主要操作中,属于过滤的是( )A、
A、1 B、2 C、3 D、410. 下列物质的性质中,属于化学性质的是( )A、液氧是淡蓝色液体 B、碳酸不稳定 C、二氧化碳比空气的密度大 D、石墨具有导电性11. 下列物质属于氧化物的是( )A、O2 B、NaCl C、CaO D、Ca(OH)212. 炒菜时油锅起火,可用锅盖盖灭,其灭火原理是()A、清除可燃物 B、隔绝空气 C、降低油的着火点 D、防止油溅出13. 面条是我国的传统食品。下列烹制面条的主要操作中,属于过滤的是( )A、 炸酱
B、
炸酱
B、 煮面
C、
煮面
C、 捞面
D、
捞面
D、 拌面
14. “含氟牙膏”可预防龋齿,元素周期表中氟元素的信息如下图所示,对图中信息理解错误的是( )
拌面
14. “含氟牙膏”可预防龋齿,元素周期表中氟元素的信息如下图所示,对图中信息理解错误的是( )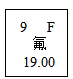 A、元素名称为氟 B、原子序数为19 C、元素符号为F D、相对原子质量为19.0015. 氕、氘、氚的原子构成如下表所示,它们都属于氢元素的原因是( )
A、元素名称为氟 B、原子序数为19 C、元素符号为F D、相对原子质量为19.0015. 氕、氘、氚的原子构成如下表所示,它们都属于氢元素的原因是( )原子种类
质子数
中子数
核外电子数
氕
1
0
1
氘
1
1
1
氚
1
2
1
A、质子数均为1 B、核外电子数均为1 C、中子数不相同 D、相对原子质量不同16. 下列酒精灯的使用方法正确的是( )A、用嘴吹灭燃着的酒精灯 B、向燃着的酒精灯里添加酒精 C、用燃着的酒精灯引燃另一只酒精灯 D、万一洒出的酒精在桌面燃烧,用湿布盖灭17. 从微粒的角度分析,下列解释错误的是( )A、水烧开后易把壶盖顶起——分子变大 B、花园里百花盛开,香气四溢——分子在不停运动 C、一氧化碳和二氧化碳的化学性质不同——分子不同 D、金刚石和石墨物理性质的差异很大——碳原子排列方式不同18. 下列实验操作不能达到实验目的的是( )选项
实验目的
实验操作
A
鉴别空气和氧气
放入带火星的木条
B
鉴别硬水和软水
加入肥皂水
C
鉴别白糖水和蒸馏水
观察颜色
D
鉴别氢氧化钠和硝酸铵
加水溶解并测温度
A、A B、B C、C D、D19. 丙烷是液化石油气的主要成分之一,下列有关叙述正确的是( ) A、丙烷的化学式为C3H8 B、丙烷由碳、氢原子构成 C、丙烷中氢元素的质量分数最大 D、丙烷中碳、氢元素质量比为3:820. 用下图装置测定空气中O2的含量,下列说法错误的是( )
A、丙烷的化学式为C3H8 B、丙烷由碳、氢原子构成 C、丙烷中氢元素的质量分数最大 D、丙烷中碳、氢元素质量比为3:820. 用下图装置测定空气中O2的含量,下列说法错误的是( )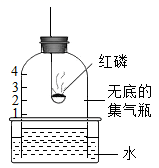 A、红磷需足量 B、瓶中液面先上升后下降 C、瓶中液面最终停留在1处 D、该实验证明氧气约占空气体积的五分之一21. 20℃时,向100g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。
A、红磷需足量 B、瓶中液面先上升后下降 C、瓶中液面最终停留在1处 D、该实验证明氧气约占空气体积的五分之一21. 20℃时,向100g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。
①溶液中的溶质为( )
A、钾 B、硝酸 C、水 D、硝酸钾22. 20℃时,向100g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。
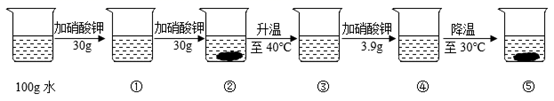 ③中溶液的质量为( )A、60g B、100g C、160g D、163.9g23. 20℃时,向100g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。
③中溶液的质量为( )A、60g B、100g C、160g D、163.9g23. 20℃时,向100g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。

①~⑤所得溶液属于饱和溶液的是( )
A、②⑤ B、②③⑤ C、②④⑤ D、②③④⑤24. 20℃时,向100g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。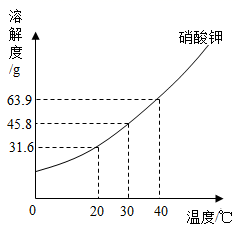

⑤中溶质质量分数的计算式为( )
A、 B、 C、 D、25. 为减少“温室效应”的危害,可将废气中的CO2进行“捕捉”并生产甲醇(CH3OH),该反应前后分子种类变化的微观示意图如下。下列说法错误的是( ) A、甲醇的相对分子质量为32 B、该化学反应前后原子种类没有改变 C、两种生成物均为化合物 D、参加反应的甲与乙的分子个数比为1:1
A、甲醇的相对分子质量为32 B、该化学反应前后原子种类没有改变 C、两种生成物均为化合物 D、参加反应的甲与乙的分子个数比为1:1二、简答题
-
26. 请从A或B两题中任选一个作答,若两题均作答,按A计分。
A补齐物质与其用途的连线
B补齐标识与其含义的连线


三、填空题
-
27. 2020年12月初,“嫦娥五号”探测器成功着陆在月球正面,并顺利完成“挖土”。
 (1)、发射“嫦娥五号”探测器的是“长征五号”遥五运载火箭, “长征五号”采用液氢和液氧推进剂,液氢、液氧在点燃条件下发生反应的化学方程式为。(2)、月壤中含有丰富的资源,如核燃料氦-3,氦-3原子的原子核内有2个质子和1个中子,则氦-3原子的核电荷数为。(3)、为避免月球样品被污染,采集回地球的月球样品必须存放在充满氮气的密封箱内,从氮气性质的角度解释其原因:。28. 能源是人类活动的物质基础。(1)、化石燃料为不可再生能源,包括、石油和天然气。(2)、沼气是经过微生物发酵产生的可燃性气体,其主要成分是甲烷。甲烷燃烧的化学方程式为。(3)、目前,北京市公交车已逐步更换为电动新能源车,改用电动公交车的优点是(答出一条即可)。29. 生活中处处有化学。(1)、我们常用洗涤剂清洗餐具上的油污,这是利用了洗涤剂的作用。(2)、生活中常用的降低水硬度的方法是 , 此方法还能杀灭水中一些病原生物。(3)、“氧来乐”是一种鱼池增氧剂,其主要成分为过氧化氢,“氧来乐”产生氧气的化学方程式为。30. 下列是关于水的实验。
(1)、发射“嫦娥五号”探测器的是“长征五号”遥五运载火箭, “长征五号”采用液氢和液氧推进剂,液氢、液氧在点燃条件下发生反应的化学方程式为。(2)、月壤中含有丰富的资源,如核燃料氦-3,氦-3原子的原子核内有2个质子和1个中子,则氦-3原子的核电荷数为。(3)、为避免月球样品被污染,采集回地球的月球样品必须存放在充满氮气的密封箱内,从氮气性质的角度解释其原因:。28. 能源是人类活动的物质基础。(1)、化石燃料为不可再生能源,包括、石油和天然气。(2)、沼气是经过微生物发酵产生的可燃性气体,其主要成分是甲烷。甲烷燃烧的化学方程式为。(3)、目前,北京市公交车已逐步更换为电动新能源车,改用电动公交车的优点是(答出一条即可)。29. 生活中处处有化学。(1)、我们常用洗涤剂清洗餐具上的油污,这是利用了洗涤剂的作用。(2)、生活中常用的降低水硬度的方法是 , 此方法还能杀灭水中一些病原生物。(3)、“氧来乐”是一种鱼池增氧剂,其主要成分为过氧化氢,“氧来乐”产生氧气的化学方程式为。30. 下列是关于水的实验。 (1)、A中水变化前后分子的种类(填“改变”或“不改变”)。(2)、B中发生反应的化学方程式为。31. 实验室制取二氧化碳,其主要步骤如下图所示。
(1)、A中水变化前后分子的种类(填“改变”或“不改变”)。(2)、B中发生反应的化学方程式为。31. 实验室制取二氧化碳,其主要步骤如下图所示。 (1)、①中,观察到水中导管口有气泡冒出,可得出的结论为。(2)、②中,发生反应的化学方程式为。(3)、③中,将燃着的木条放在瓶口,观察到 , 证明二氧化碳已收集满。32. 实验室要配制50g10%的氯化钠溶液,其操作如下图所示。
(1)、①中,观察到水中导管口有气泡冒出,可得出的结论为。(2)、②中,发生反应的化学方程式为。(3)、③中,将燃着的木条放在瓶口,观察到 , 证明二氧化碳已收集满。32. 实验室要配制50g10%的氯化钠溶液,其操作如下图所示。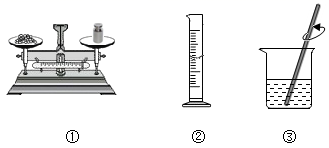 (1)、①中称量氯化钠固体的质量为g。(2)、下列量筒中,最适于②中量取水的是(填序号)。
(1)、①中称量氯化钠固体的质量为g。(2)、下列量筒中,最适于②中量取水的是(填序号)。Al0 mL量筒 B50 mL量筒 Cl00 mL量筒
(3)、③中玻璃棒的作用是。四、科普阅读题
-
33. 阅读下面科普短文。
酒精,又名乙醇,化学式为C2H5OH,在常温常压下是一种易燃、易挥发的无色液体,有特殊香味,能与水以任意比互溶。乙醇用途广泛,可用于制造饮料、香精、染料、燃料等。工业上常用淀粉发酵法制酒精,其主要流程如下:

医用酒精主要用于消毒、杀菌。酒精浓度过高时,会在细菌表面形成一层保护膜,阻止其进入细菌体内,不能彻底杀死细菌;浓度过低时,不能将细菌体内的蛋白质凝固,同样无法将细菌杀死。因此,浓度适当的酒精溶液,才能达到良好的杀菌效果。经实验测定,酒精杀菌效果较好的浓度范围是50%-80%,常用的医用浓度为75%。下表是不同浓度酒精杀灭细菌所需的时间。
酒精浓度
金黄色葡萄球菌
溶血性链球菌
大肠杆菌
40%
4小时
2分钟
2分钟
50%
2小时
20秒
20秒
60%
30分钟
10秒
20秒
70%
5分钟
10秒
30秒
80%
2分钟
10秒
1小时
90%
30分钟
5分钟
15小时
100%
7天
15分钟
24小时
乙醇还可以通过各种植物纤维发酵制得,将其按一定比例与汽油混合,即成为一种新型替代能源——乙醇汽油。乙醇汽油作为汽车燃料,可节省石油资源,减少汽车尾气对空气的污染,还可以促进农业生产。
依据文章内容回答下列问题。
(1)、乙醇属于(填“有机物”或“无机物”)。(2)、淀粉发酵法制酒精时,发生的主要反应为:C6H12O6 2C2H5OH+2CO2↑,此反应属于基本反应类型中的反应。(3)、酒精浓度为时,杀灭金黄色葡萄球菌速度最快。(4)、酒精杀灭溶血性链球菌所需时间与其浓度的关系是。(5)、下列说法正确的是(填序号)。A淀粉发酵法制酒精的过程,只发生化学变化
B使用酒精做消毒剂时,其浓度越大杀菌速度越快
C乙醇汽油的使用,对空气质量的改善有一定作用
D酒精用途广泛,发展前景广阔
五、流程题
-
34. 以空气等为原料合成尿素[CO(NH2)2]的转化过程如下:
 (1)、空气属于(填“纯净物”或“混合物”)(2)、在高温、高压和催化剂的作用下,反应②的化学方程式为。(3)、补全反应④的化学方程式:2NH3+CO2 CO(NH2)2+。35. 某工厂产生的废气中含有SO2和NO,直接排放会污染空气。无害化处理的主要流程如下:
(1)、空气属于(填“纯净物”或“混合物”)(2)、在高温、高压和催化剂的作用下,反应②的化学方程式为。(3)、补全反应④的化学方程式:2NH3+CO2 CO(NH2)2+。35. 某工厂产生的废气中含有SO2和NO,直接排放会污染空气。无害化处理的主要流程如下: (1)、SO2中S的化合价为。(2)、管式反应器中,通入臭氧(O3)的目的是将NO转化为。(3)、塔式反应器中,废气从底端通入,浓氨水从顶端喷淋注入,其目的是。
(1)、SO2中S的化合价为。(2)、管式反应器中,通入臭氧(O3)的目的是将NO转化为。(3)、塔式反应器中,废气从底端通入,浓氨水从顶端喷淋注入,其目的是。六、实验题
-
36. 用下图装置进行实验。
 (1)、高锰酸钾分解的化学方程式为。(2)、铁丝在氧气中燃烧的现象为剧烈燃烧, , 放热,生成黑色固体。37. 用下图所示实验验证可燃物燃烧的条件,表中为①~④处所放药品。
(1)、高锰酸钾分解的化学方程式为。(2)、铁丝在氧气中燃烧的现象为剧烈燃烧, , 放热,生成黑色固体。37. 用下图所示实验验证可燃物燃烧的条件,表中为①~④处所放药品。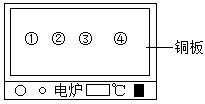
序号
①
②
③
④
药品
白磷
红磷
被沙子覆盖的白磷
被沙子覆盖的红磷
已知:白磷的着火点为40 ℃,红磷的着火点为240 ℃。
(1)、升温至60℃,对比(填序号),可知可燃物燃烧需要温度达到着火点。(2)、设计①、③的目的是。七、科学探究题
-
38. 用石蕊溶液染成紫色的干燥纸花,验证二氧化碳的性质。
序号
①
②
③
④
操作




现象
紫花变红
紫花不变色
紫花变红
(1)、实验②中的现象为。(2)、实验③的目的是。(3)、依据实验①~④的现象,可得出的结论是。39. 某小组同学在进行“木炭在氧气中燃烧”实验时,未观察到明显的“发白光”现象,为探究其原因,进行了如下实验。(进行试验)
实验1:取三瓶氧气,进行实验。
装置
序号
1-1
1-2
1-3
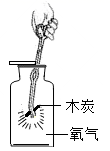
木炭质量/g
2
2
x
木炭形状
块状

片状

锥状

现象
木炭燃烧,
发光颜色偏黄、较暗
木炭燃烧,
发光颜色偏黄、较亮
木炭尖端迅速燃烧,发光颜色偏白、较亮
实验2:取与实验1-3中形状、质量相同的木炭,进行实验。
序号
2-1
2-2
2-3
装置



现象
木炭尖端迅速燃烧,发光颜色偏黄、较亮
木炭尖端迅速燃烧,发光颜色偏白、较亮
木炭尖端迅速燃烧,发出白光、明亮耀眼
(解释与结论)
(1)、木炭与氧气反应的化学方程式为。(2)、能验证木炭在氧气中燃烧产物的现象是。(3)、实验1-3中,x为。(4)、实验1的目的是。(5)、实验2中,三个实验出现不同现象的原因是。(6)、(反思与评价)依据上述实验可知,影响可燃物燃烧剧烈程度的因素有。
八、计算题
-
40. 高纯硅(Si)可用于制作光感电池,工业制备高纯硅的化学反应为:2H2 + SiCl4 Si + 4HCl。计算生产14g硅需要氢气的质量。
-
-