北京市朝阳区2020-2021学年九年级上学期化学期末考试试卷
试卷更新日期:2021-03-04 类型:期末考试
一、单选题
-
1. 下列变化中,属于物理变化的是( )A、粮食酿酒 B、瓷碗破碎 C、食物腐败 D、火药爆炸2. 下列食物富含蛋白质的是( )A、鸡蛋 B、米饭 C、白菜 D、西瓜3. 下列元素中,因摄入量不足可能导致骨质疏松的是( )A、铁 B、钠 C、钙 D、锌4. 空气成分中,体积分数最大的是( )A、氮气 B、二氧化碳 C、氧气 D、稀有气体5. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )A、铁丝 B、红磷 C、碳 D、硫6. 下列属于有机合成材料的是( )A、陶瓷 B、塑料保鲜膜 C、不锈钢 D、羊绒衫7. 下列实验操作正确的是( )A、
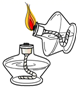 点燃酒精灯
B、
点燃酒精灯
B、 称量固体
C、
称量固体
C、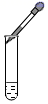 滴加液体
D、
滴加液体
D、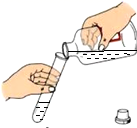 取用液体
8. 下列物质中,属于氧化物的是( )A、KCl B、NaOH C、SO2 D、H2SO49. “含氟牙膏”中的“氟”指的是()A、分子 B、原子 C、单质 D、元素10. 下列净水方法中,净化程度最高的是( )A、蒸馏 B、消毒 C、吸附 D、沉淀11. 食品包装中经常用到铝箔,铝能制成铝箔是因为铝具有( )A、金属光泽 B、抗腐蚀性 C、导热性 D、延展性12. 《天工开物》中记载的炼锡方法为: ,该反应属( )A、置换反应 B、分解反应 C、化合反应 D、无法判断13. 用水壶烧开水,水沸腾后壶盖被顶起,说明( )A、分子由原子构成 B、分子的质量增大 C、分子的体积变大 D、分子间间隔增大14. 表示“两个氢分子”的是( )A、H2 B、H2O C、2H2 D、2H15. 钠元素和氯元素的本质区别在于( )A、相对原子质量不同 B、质子数不同 C、最外层电子数不同 D、中子数不同16. 下列图标中,表示“禁止烟火”的是( )A、
取用液体
8. 下列物质中,属于氧化物的是( )A、KCl B、NaOH C、SO2 D、H2SO49. “含氟牙膏”中的“氟”指的是()A、分子 B、原子 C、单质 D、元素10. 下列净水方法中,净化程度最高的是( )A、蒸馏 B、消毒 C、吸附 D、沉淀11. 食品包装中经常用到铝箔,铝能制成铝箔是因为铝具有( )A、金属光泽 B、抗腐蚀性 C、导热性 D、延展性12. 《天工开物》中记载的炼锡方法为: ,该反应属( )A、置换反应 B、分解反应 C、化合反应 D、无法判断13. 用水壶烧开水,水沸腾后壶盖被顶起,说明( )A、分子由原子构成 B、分子的质量增大 C、分子的体积变大 D、分子间间隔增大14. 表示“两个氢分子”的是( )A、H2 B、H2O C、2H2 D、2H15. 钠元素和氯元素的本质区别在于( )A、相对原子质量不同 B、质子数不同 C、最外层电子数不同 D、中子数不同16. 下列图标中,表示“禁止烟火”的是( )A、 B、
B、 C、
C、 D、
D、 17. 下列化学式书写正确的是( )A、氧化铝 AlO B、硫酸锌 ZnSO4 C、氯化铁 FeCl2 D、硝酸铜 CuNO318. 密闭居室内使用燃气热水器容易使人中毒,使人中毒的气体是( )A、CO2 B、CO C、O2 D、N219. 下列做法安全可行的是( )A、电器着火,用水浇灭 B、高楼发生火灾,乘电梯逃生 C、在加油站拨打或接听移动电话 D、档案资料着火,用液态二氧化碳扑灭20. 下列关于物质用途的描述错误的是( )A、氧气可用作燃料 B、氮气可用于食品防腐 C、干冰可用于人工降雨 D、二氧化碳可用作气体肥料21. 钼主要用于航天合金材料制作,如图是钼元素在元素周期表中的信息,下列说法错误的是( )
17. 下列化学式书写正确的是( )A、氧化铝 AlO B、硫酸锌 ZnSO4 C、氯化铁 FeCl2 D、硝酸铜 CuNO318. 密闭居室内使用燃气热水器容易使人中毒,使人中毒的气体是( )A、CO2 B、CO C、O2 D、N219. 下列做法安全可行的是( )A、电器着火,用水浇灭 B、高楼发生火灾,乘电梯逃生 C、在加油站拨打或接听移动电话 D、档案资料着火,用液态二氧化碳扑灭20. 下列关于物质用途的描述错误的是( )A、氧气可用作燃料 B、氮气可用于食品防腐 C、干冰可用于人工降雨 D、二氧化碳可用作气体肥料21. 钼主要用于航天合金材料制作,如图是钼元素在元素周期表中的信息,下列说法错误的是( ) A、属于金属元素 B、相对原子质量为95.96g C、原子核内质子数为42 D、原子核外电子数为4222. 绿茶中含有的单宁酸( )具有抑制血压上升、清热解毒等功效,下列有关单宁酸的说法正确的是( )A、相对分子质量为174 B、由碳原子、氢分子和氧分子构成 C、氢元素的质量分数最小 D、碳、氧两种元素的质量比为76:4623. 下列实验得出的结论,正确的是( )
A、属于金属元素 B、相对原子质量为95.96g C、原子核内质子数为42 D、原子核外电子数为4222. 绿茶中含有的单宁酸( )具有抑制血压上升、清热解毒等功效,下列有关单宁酸的说法正确的是( )A、相对分子质量为174 B、由碳原子、氢分子和氧分子构成 C、氢元素的质量分数最小 D、碳、氧两种元素的质量比为76:4623. 下列实验得出的结论,正确的是( )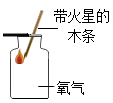
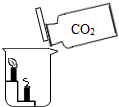

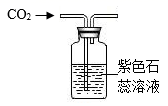
A.氧气已收集满
B.二氧化碳密度比空气大,不可燃也不助燃
C.该实验可以验证质量守恒定律
D.二氧化碳能与水反应
A、A B、B C、C D、D24. 硼纤维具有较好的耐热性和弹性,不与氯气、水反应,可与某些金属制成新型材料。在1200℃~1300℃时,氯化硼(BCl3)蒸气与干燥、纯净的氢气反应可制得硼和氯化氢。下列说法错误的是( )A、含硼纤维的材料可能具有耐热性 B、氯化硼可能与水反应 C、该反应中只有两种物质为气态 D、该反应需要在隔绝空气的条件下进行25. 生产VR(虚拟现实)设备的材料之一是硅(Si),工业制取高纯硅的微观示意图如图,下列有关说法错误的是( )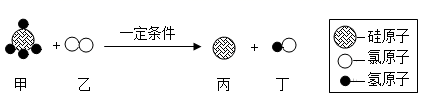 A、甲属于化合物 B、反应中乙和丁的分子个数比为1:2 C、反应前后氢、氯原子个数发生改变 D、参加反应的甲和乙的质量比为16:71
A、甲属于化合物 B、反应中乙和丁的分子个数比为1:2 C、反应前后氢、氯原子个数发生改变 D、参加反应的甲和乙的质量比为16:71二、填空题
-
26. 新能源汽车的发展对缓解能源危机和环境污染有重要作用。(1)、传统汽车采用化石燃料作为能源。化石燃料包括煤、和天然气,天然气中甲烷燃烧的化学方程式为。(2)、氢燃料电池车实现交通“零排放”的原因是(用化学方程式解释)。27. 金属与我们生活息息相关。(1)、泡沫铁粉可用于食品保鲜的原理:铁能吸收 , 从而使食品保持干燥并防止氧化变质。(2)、锈蚀钢铁回收重新冶炼是保护金属资源的一条有效途径。写出用CO还原锈蚀钢铁的化学方程式。28. 碳纤维是含碳量高于90%的新型材料,密度比铝小,强度比钢大。为了提高碳纤维的强度,必须选择适当的预氧化条件。将碳纤维进行预氧化处理,测得碳纤维强度与热处理温度的关系如图所示。
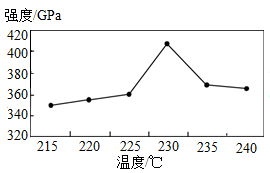 (1)、碳纤维的物理性质有。(2)、由图可知,碳纤维强度与热处理温度的关系是。
(1)、碳纤维的物理性质有。(2)、由图可知,碳纤维强度与热处理温度的关系是。三、科普阅读题
-
29. 阅读下面科普短文。
“琉璃”与“玻璃”
“琉璃”与“玻璃”常被混为一谈。“琉璃”常指珍贵的饰品,“玻璃”制品在清中期以前常被误认为是“琉璃”制品。
琉璃与玻璃的成分、性能及用途
名称
主要成分
其他成分
性能及用途
琉璃
二氧化硅
最多达到90%
金属氧化物(氧化铝、氧化钴、氧化铅)约8%~10%
具有特殊的金属色泽,可用于制作流光溢彩的饰品、有釉的陶制建筑用品等
玻璃
二氧化硅
92%~99%
金属氧化物(氧化钙、氧化铅)只占1%左右
具有非常好的透光度和折光率,可生产试管、烧杯等化学仪器
在古代,玻璃、有釉的陶器(如琉璃瓦)等都统称为“琉璃”。在明代景泰年间,工匠们把含有金属氧化物的二氧化硅碾成粉末,做成“涂料”,涂在铜胎上,高温炼制成琉璃艺术珍品——景泰蓝。现今,“琉璃”则指用传统工艺制作的玻璃艺术品,多为手工制作。
玻璃是一种无规则结构的非晶态固体,没有固定的熔点。人们在普通玻璃中掺入某种金属氧化物,可以生产出有特定色彩的玻璃。例如,加入氧化钴使玻璃呈现蓝色,加入氧化亚铜使玻璃呈现红色,加入二氧化锰使玻璃呈现紫色等。将普通玻璃加热到700℃左右,再进行快速均匀的冷却就能得到钢化玻璃。钢化玻璃强度大、不容易破碎,即使破碎也会以无锐角的颗粒形式碎裂,对人体伤害大大降低。防盗玻璃为多层结构,每层中间嵌有极细的金属丝,当击碎玻璃时,与金属丝相连的电子警报系统立即发出报警信号。总之,化学材料的研发将为人类社会的发展做出新的贡献。
依据文章内容回答下列问题:
(1)、“琉璃”与“玻璃”均属于(填“纯净物”或“混合物”)。(2)、“防盗玻璃”能报警,这是利用了金属的。(3)、“琉璃”与“玻璃”的化学成分的主要区别是 (写出一条即可)。(4)、根据文中介绍的玻璃种类,私家车前挡风玻璃最好使用。(5)、下列有关“琉璃”与“玻璃”的描述,正确的是(填序号)。A “景泰蓝”是琉璃制品中的一种
B玻璃属于非晶态固体,有固定的熔点
C不同颜色的“玻璃”是因为其成分中含有不同的金属氧化物
D化学仪器多为玻璃制作,是因为玻璃的透光度和折光率好
四、流程题
-
30. 金属钨(W)可做白炽灯泡的灯丝,用黑钨矿[主要含有钨酸亚铁(FeWO4)]制得金属钨的工艺流程如图所示。
已知:WO3是难溶于水的固体。
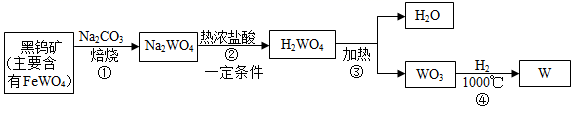 (1)、FeWO4中钨元素的化合价为。(2)、反应②的化学方程式为: ,X的化学式为。(3)、反应③的化学方程式为。31. 工业上用石灰石为原料制备纳米CaCO3的一种流程如图所示。已知:SiO2不与盐酸反应
(1)、FeWO4中钨元素的化合价为。(2)、反应②的化学方程式为: ,X的化学式为。(3)、反应③的化学方程式为。31. 工业上用石灰石为原料制备纳米CaCO3的一种流程如图所示。已知:SiO2不与盐酸反应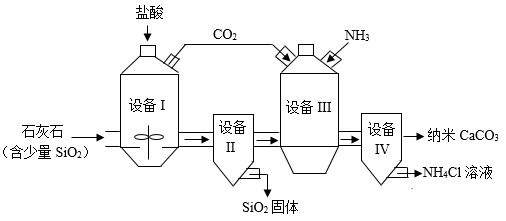 (1)、设备Ⅰ中需不断搅拌,其目的是。设备Ⅰ中发生反应的化学方程式为。(2)、设备Ⅱ和设备Ⅳ均为分离设备,设备Ⅳ中的分离操作是。(3)、设备Ⅲ中参加反应的物质除水外,还有。
(1)、设备Ⅰ中需不断搅拌,其目的是。设备Ⅰ中发生反应的化学方程式为。(2)、设备Ⅱ和设备Ⅳ均为分离设备,设备Ⅳ中的分离操作是。(3)、设备Ⅲ中参加反应的物质除水外,还有。五、简答题
-
32. 根据如图所示实验,回答问题。
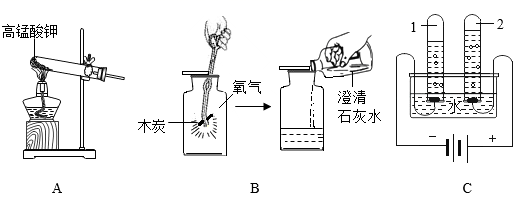 (1)、实验A,发生反应的化学方程式为 , 能用排水法收集氧气的原因是。(2)、实验B,能说明木炭燃烧的产物为二氧化碳的依据是(用化学方程式表示)。(3)、实验C,试管2中产生的气体是 , 该实验证明水由组成。
(1)、实验A,发生反应的化学方程式为 , 能用排水法收集氧气的原因是。(2)、实验B,能说明木炭燃烧的产物为二氧化碳的依据是(用化学方程式表示)。(3)、实验C,试管2中产生的气体是 , 该实验证明水由组成。六、实验题
-
33. 根据如图所示实验,回答问题。
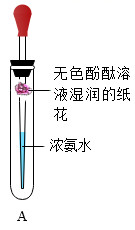
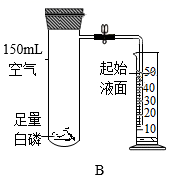 (1)、实验A能说明氨分子不断运动的实验现象是 , 该实验说明浓氨水具有 性。(2)、实验B验证了空气中氧气的含量,白磷的作用是 , 白磷熄灭试管冷却后再打开止水夹,水倒流入试管中,最终量筒中液面约降至 mL刻度线处,原因。34. 利用如图装置探究“温度达到着火点是可燃物燃烧的条件之一”。实验中观察到甲中白磷燃烧,乙中白磷不燃烧。
(1)、实验A能说明氨分子不断运动的实验现象是 , 该实验说明浓氨水具有 性。(2)、实验B验证了空气中氧气的含量,白磷的作用是 , 白磷熄灭试管冷却后再打开止水夹,水倒流入试管中,最终量筒中液面约降至 mL刻度线处,原因。34. 利用如图装置探究“温度达到着火点是可燃物燃烧的条件之一”。实验中观察到甲中白磷燃烧,乙中白磷不燃烧。已知:白磷的着火点是40℃
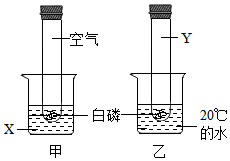 (1)、甲中白磷燃烧的化学方程式为。(2)、甲中的X、乙中的Y分别为。(3)、若验证可燃物燃烧的另一个条件,还需要补充的实验是。35. 化学小组利用如图所示装置进行实验。
(1)、甲中白磷燃烧的化学方程式为。(2)、甲中的X、乙中的Y分别为。(3)、若验证可燃物燃烧的另一个条件,还需要补充的实验是。35. 化学小组利用如图所示装置进行实验。实验装置
实验药品
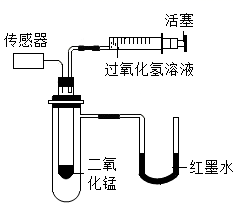
过氧化氢溶液
二氧化锰
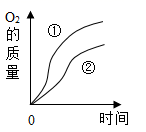
①
10 mL 3.4%
0.2g
②
10 mL 2.4%
0.2g
(1)、小试管中发生反应的化学方程式为。(2)、设计实验①和实验②的目的是。(3)、实验过程中,还观察到U型管右侧液面均上升,依据此现象可推测该反应是反应。七、科学探究题
-
36. 小组同学收集了某种铝制易拉罐,剪成条状并打磨后进行如图所示实验,发现纯铝片表面有划痕。
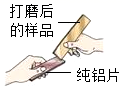
(发现问题)结合上述现象,可得出该易拉罐不是纯铝制作。那么易拉罐中除铝外,还含有什么金属呢?
(查阅资料)①铝制易拉罐中的主要成分是铝,可能还含有镁、铁。
②铝能与氢氧化钠溶液反应: ,镁和铁不能与氢氧化钠溶液反应。
(猜想与假设)该易拉罐中除铝外,可能还含有镁、铁中的一种或两种。
(进行实验)小明取打磨后的铝制易拉罐样品按如下方案进行实验:
实验步骤
实验现象
实验结论
实验1
取一定量的样品于烧杯中,加入足量的溶液A,充分反应
产生大量气泡,烧杯底部有黑色固体剩余
样品中含铝
实验2
取实验1中少量黑色固体于试管中,加入足量的稀盐酸
固体消失,产生气泡,溶液变为浅绿色
样品中含铁
(解释与结论)
(1)、纯铝片表面有划痕,说明合金的硬度比组成它的纯金属更。(2)、实验1中,加入的溶液A是溶液。(3)、实验2中,能证明样品中含有铁的实验现象是。(4)、(反思与评价)其他同学分析后认为小明的实验方案不严谨,理由是。
(5)、大家认为应该补充下列实验:取实验1中少量黑色固体于试管中,加入某种金属的化合物溶液,若无现象,则小明的结论正确。你认为加入的金属化合物溶液中的金属元素可能是(填一种即可)。(6)、废弃易拉罐应放入标有(填序号)图标的垃圾桶内。
八、计算题
-
37. 《梦溪笔谈》中记录了在用铁釜盛装硫酸铜溶液熬制硫酸铜晶体时,铁釜用久了会化作铜。(1)、由上述材料可知,铁比铜的金属活动性。(2)、向足量的硫酸铜溶液中加入11.2 g铁粉,充分反应后,理论上可以得到铜的质量是多少?
-
-
-