初中化学人教版一轮复习 考点9 常见的酸和碱
试卷更新日期:2021-03-03 类型:一轮复习
一、单选题
-
1. 能使无色酚酞试液变红色的是( )A、氯化钠溶液 B、盐酸 C、氯化铵溶液 D、氢氧化钠溶液2. 下列物质露置在空气中一段时间后,因为发生化学变化而质量增加的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠溶液 D、过氧化氢溶液3. 对下列事实的解释错误的是( )
选项
事实
解释
A
酒精溶液不能导电
溶液中没有自由移动的带电粒子
B
稀硫酸、稀盐酸都能使紫色石蕊溶液变红色
溶液中都含有氢离子
C
白色纸张沾浓硫酸后变黑
浓硫酸具有吸水性,能使纸张炭化
D
硫酸铜和氯化铜溶液都呈蓝色
溶液中都含有铜离子
A、A B、B C、C D、D4. 规范的实验操作可以避免一些危险和试剂的污染等,下列实验操作不规范的是( )A、 蒸发食盐水
B、
蒸发食盐水
B、 称取一定量氯化钠固体
C、
称取一定量氯化钠固体
C、 向试管中加入食盐粉末
D、
向试管中加入食盐粉末
D、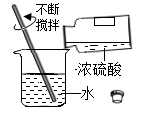 稀释浓硫酸
5. 化学课上,化学老师为同学们表演了小魔术,他将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“化学真奇妙”的红色大字立刻显现于纸上。他所用的试剂可能是下列哪一组( )A、酚酞——石灰水溶液 B、酚酞——盐酸溶液 C、石蕊——石灰水溶液 D、石蕊——盐酸溶液6. 用下图所示装置进行下列实验。其中,氢氧化钠溶液用于吸收硫燃烧产生的有毒气体二氧化硫。
稀释浓硫酸
5. 化学课上,化学老师为同学们表演了小魔术,他将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“化学真奇妙”的红色大字立刻显现于纸上。他所用的试剂可能是下列哪一组( )A、酚酞——石灰水溶液 B、酚酞——盐酸溶液 C、石蕊——石灰水溶液 D、石蕊——盐酸溶液6. 用下图所示装置进行下列实验。其中,氢氧化钠溶液用于吸收硫燃烧产生的有毒气体二氧化硫。
步骤1:从A处通入空气,点燃酒精灯,观察到硫粉熔化、燃烧,产生微弱的淡蓝色火焰;
步骤2:从A处改通入氧气,观察到硫燃烧产生明亮的蓝紫色火焰。
下列说法错误的是( )
A、检查该装置气密性的操作:堵住A口,将导气管伸入液面以下,双手紧握U型管 B、实验结束时,继续通入气体,停止加热,一段时间后把导气管移出液面 C、步骤1中,硫粉只发生了化学变化 D、上述实验说明,氧气含量的高低是影响硫燃烧现象的因素之一7. 小明同学归纳总结了初中所学稀硫酸的化学性质,并用“H2SO4+X→盐+Y”这种表达式进行整理。下列小明的观点错误的是( )选项
X的物质类别
观点描述
A
金属
若X为Cu,则反应能够发生
B
金属氧化物
若X为MgO,则Y为H2O
C
碱
若X为NaOH,则盐为Na2SO4
D
盐
若X为BaCl2 , 则生成白色沉淀
A、A B、B C、C D、D8. 科学实验中,药品和仪器的存放要符合一定的规范。下列物质存放在对应的仪器中,符合规范的是(提示:氢气是一种无色无味的气体,是自然界中最轻的气体,难溶于水)( )A、碳酸钙固体 B、氢氧化钠溶液
B、氢氧化钠溶液  C、氢气
C、氢气  D、稀盐酸溶液
D、稀盐酸溶液  9. 下列实验操作错误的是( )A、用滴管取液体
9. 下列实验操作错误的是( )A、用滴管取液体 B、熄灭酒精灯
B、熄灭酒精灯  C、蒸发食盐水
C、蒸发食盐水  D、稀释浓硫酸
D、稀释浓硫酸  10. 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸。下列图像能正确反映其对应变化关系的是( )A、
10. 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸。下列图像能正确反映其对应变化关系的是( )A、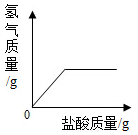 B、
B、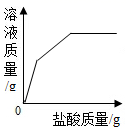 C、
C、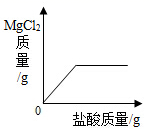 D、
D、 11. 学习了化学,我们掌握了宏观辨识与微观探析物质的本领。对以下物质的辨别方法及微观解释,错误的是( )A、用带火星木条辨别氧气与二氧化碳——氧分子能助燃,二氧化碳分子不支持燃烧 B、用氯化钡溶液辨别硝酸银溶液与硫酸钠溶液—一银离子与氯离子结合生成氯化银,钡离子与硫酸根离子结合生成硫酸钡 C、用燃烧法辨别碳纤维与蚕丝纤维一一碳纤维由碳原子构成,蚕丝纤维由蛋白质分子构成 D、用酸碱指示剂辨别稀盐酸与氢氧化钠溶液一一盐酸中含有氢离子,氢氧化钠溶液中含有氢氧根离子12. 下列关于Ca(OH)2的说法错误的是( )A、微溶于水,水溶液呈碱性 B、能与酸反应,可用于治疗胃酸过多 C、与CuSO4溶液按一定比例混合,可配制波尔多液 D、澄清溶液可用来检验CO213. 下列关于硫酸的认识,正确的是( )A、组成:硫酸溶液中H+和SO 的数目相同 B、性质:能与CO2、SO3等非金属氧化物反应 C、用途:可用于实验室制备CuSO4等硫酸盐 D、生产:含硫酸废水用CaCl2处理后直接排放14. 下列各组物质不能实现如图所示的转化关系的是( )
11. 学习了化学,我们掌握了宏观辨识与微观探析物质的本领。对以下物质的辨别方法及微观解释,错误的是( )A、用带火星木条辨别氧气与二氧化碳——氧分子能助燃,二氧化碳分子不支持燃烧 B、用氯化钡溶液辨别硝酸银溶液与硫酸钠溶液—一银离子与氯离子结合生成氯化银,钡离子与硫酸根离子结合生成硫酸钡 C、用燃烧法辨别碳纤维与蚕丝纤维一一碳纤维由碳原子构成,蚕丝纤维由蛋白质分子构成 D、用酸碱指示剂辨别稀盐酸与氢氧化钠溶液一一盐酸中含有氢离子,氢氧化钠溶液中含有氢氧根离子12. 下列关于Ca(OH)2的说法错误的是( )A、微溶于水,水溶液呈碱性 B、能与酸反应,可用于治疗胃酸过多 C、与CuSO4溶液按一定比例混合,可配制波尔多液 D、澄清溶液可用来检验CO213. 下列关于硫酸的认识,正确的是( )A、组成:硫酸溶液中H+和SO 的数目相同 B、性质:能与CO2、SO3等非金属氧化物反应 C、用途:可用于实验室制备CuSO4等硫酸盐 D、生产:含硫酸废水用CaCl2处理后直接排放14. 下列各组物质不能实现如图所示的转化关系的是( )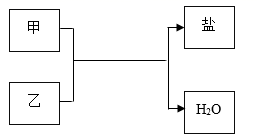
选项
甲
乙
A
Fe2O3
稀硫酸
B
SO3
NaOH溶液
C
稀盐酸
Ca(OH)2溶液
D
稀盐酸
AgNO3溶液
A、A B、B C、C D、D二、填空题
-
15. 归纳总结是学习知识的重要方法。小军同学用图1总结了NaOH的四条化学性质。
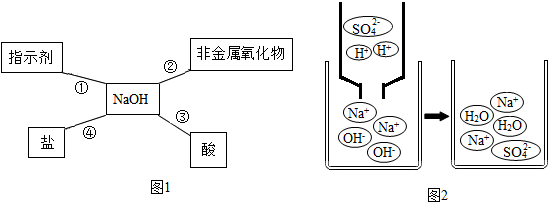 (1)、图2利用微观示意图来说明反应③的发生,请写出该反应的化学方程式:;从该图还可以看出,反应后的溶液pH7(填“>”“一”或“<”)。(2)、如果反应④能够发生,你选择的物质是______(填序号)。A、HCl B、Na2CO3 C、CuSO4(3)、另外,NaOH溶波还能与某些金属(如Al)发生反应,请配平该反应的化学方程式: NaOH+ H2O+Al=NaAlO2+H2↑16. 硫酸和盐酸是两种重要的化工原料。(1)、浓硫酸常用作干燥剂因为它具有 , 浓盐酸因为有而要密封保存。(2)、写出稀硫酸与下类物质反应的化学方程式。
(1)、图2利用微观示意图来说明反应③的发生,请写出该反应的化学方程式:;从该图还可以看出,反应后的溶液pH7(填“>”“一”或“<”)。(2)、如果反应④能够发生,你选择的物质是______(填序号)。A、HCl B、Na2CO3 C、CuSO4(3)、另外,NaOH溶波还能与某些金属(如Al)发生反应,请配平该反应的化学方程式: NaOH+ H2O+Al=NaAlO2+H2↑16. 硫酸和盐酸是两种重要的化工原料。(1)、浓硫酸常用作干燥剂因为它具有 , 浓盐酸因为有而要密封保存。(2)、写出稀硫酸与下类物质反应的化学方程式。①和镁条的反应:。
②和碳酸钠溶液反应:。
③和氯化钡溶液反应:。
上述反应中属于复分解反应的有;属于酸的共同性质的有 (填编号);不同的酸性质差异的原因。
(3)、盐酸的下列用途中,不能用硫酸代替盐酸的是。(填编号)①金属表面除锈 ②制造药物氯化锌 ③除去氯化钠中的少量碳酸钠
(4)、某实验小组探究酸的化学性质,在做盐酸除铁锈的试验时发现:铁锈的主要成分是 , 为除去铁钉上的锈迹,某学生将带锈迹的铁钉放入过量的盐酸中,他首先看到锈迹溶解,溶液呈色。这是因为(用化学方程式表示);不一会儿,又看到溶液中有的现象,这是因为铁钉部分溶解(用化学方程式表示)。三、综合题
-
17. 氢溴酸为溴化氢气体的水溶液,是无色液体,打开盛氢溴酸的试剂瓶盖,可以看到有白雾生成。氢溴酸有强酸性,能与除铂、金和钽等金属外的很多金属发生反应。(1)、通过阅读,可知氢溴酸的物理性质有(至少写出两条)。(2)、将紫色石蕊试液滴到氢溴酸中,可以看到。(3)、氢溴酸是一种和盐酸性质非常相似的一种酸。已知:盐酸在水中的解离可以表示为HCl→H++Cl﹣ , 其解离过程如图所示,氢溴酸的解离可以表示为。
 (4)、请写出氢溴酸与金属铁、碳酸钠发生反应的化学方程式:、。18. 某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(4)、请写出氢溴酸与金属铁、碳酸钠发生反应的化学方程式:、。18. 某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。 (1)、编号①反应的指示剂是;编号②反应的金属单质是。(2)、根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是反应。(3)、请你写出符合编号③反应的化学方程式。(4)、假设编号④反应的盐是AgNO3 , 则编号④对应方框中的现象是。
(1)、编号①反应的指示剂是;编号②反应的金属单质是。(2)、根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是反应。(3)、请你写出符合编号③反应的化学方程式。(4)、假设编号④反应的盐是AgNO3 , 则编号④对应方框中的现象是。四、实验探究题
-
19. 某化学课堂围绕“酸碱盐的性质”,将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格。
A小组同学发现实验台上摆放的药品中(如图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
(提出问题)这瓶溶液是什么溶液?
(获得信息)
酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
(提出猜想)这瓶溶液可能是:1、氯化钠溶液;2、氢氧化钠溶液;3、碳酸钠溶液。
(实验推断)
(1)、小丽取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是溶液,理由是。(2)、小华取来一个装满二氧化碳的软质塑料瓶,将该溶液倒进塑料瓶中一部分,迅速拧紧瓶盖,振荡,结果瓶子变瘪。小华得出结论:该溶液是氢氧化钠溶液。小明同学认为小华的结论不正确,理由是。(3)、小刚另取样滴加稀盐酸有产生,小刚得出结论:该溶液是碳酸钠溶液。小青认为小刚的结论不完全正确,理由是。(4)、小组同学讨论后一致认为还需要进行如下实验:(继续探究)另取样品加入过量的CaCl2溶液,可观察到有产生,反应的化学方程式为 , 设计这一步骤的目的是;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
(5)、(实验结论)这瓶溶液是。(探究启示)实验取完药品后应。
20. 某化学兴趣小组同学为探究硫酸的化学性质,做了如下实验: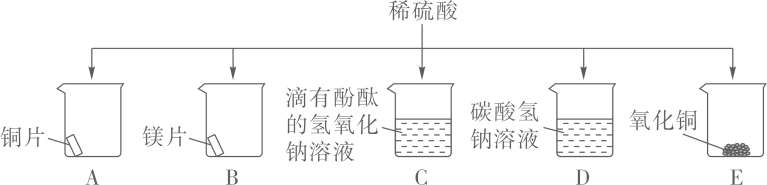 (1)、能产生气泡的是(填序号);(2)、溶液变为蓝色的是(填序号),写出其中发生的化学方程式。(3)、能证明C中发生了反应的现象是。(4)、实验过程中,发现只有A中无明显现象,说明铜与稀硫酸不发生反应。
(1)、能产生气泡的是(填序号);(2)、溶液变为蓝色的是(填序号),写出其中发生的化学方程式。(3)、能证明C中发生了反应的现象是。(4)、实验过程中,发现只有A中无明显现象,说明铜与稀硫酸不发生反应。(提出问题)铜与硫酸真的不能反应吗?
(查阅资料)
①铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
②SO2能使品红溶液褪色;
③SO2能与碱溶液反应;
④SO2能溶于水,但不溶于饱和NaHSO3溶液
(进行实验)
同学们在老师的帮助下用如图所示装置进行实验:

请回答下列问题:
实验开始时,打开开关K,发现D中品红溶液褪色,装置D中试管口放置的棉花上浸有浓氢氧化钠溶液,其作用是。
(5)、装置B的作用是收集贮存多余的气体,当D中有明显现象后,关闭K,移去酒精灯,但由于余热的作用,A有仍有气体产生,此时B中现象是:长颈漏斗内液面(填“上升”或“下降”),则B中盛放的液体为(填序号)A、水
B、氢氧化钠溶液
C、饱和石灰水
D、饱和NaHSO3溶液
(知识拓展)化学反应的进行与物质的溶质质量分数,反应条件都有一定的关系。
五、计算题
-
21. 某兴趣小组为了探究一瓶久置的氢氧化钠溶液的变质情况,取出100g该溶液样品进行实验,依次加入质量分数4.9%的稀硫酸,测得的实验数据如下表所示:
实验编号
①
②
③
④
⑤
稀硫酸的质量(g)
20.0
40.0
60.0
80.0
100.0
溶液的总质量(g)
120.0
140.0
159.78
179.56
199.56
请回答下列问题:
(1)、实验①﹑②没有产生气体的原因是。(2)、100g溶液样品中碳酸钠的质量 。(3)、计算100g溶液样品中已经变质的氢氧化钠的质量(写出计算过程)(4)、分析实验数据,在下图中,画出加入4.9%的稀硫酸质量0—80.0g过程中,产生气体质量对应的变化图,并标注必要的数值。