初中化学人教版一轮复习 考点8 金属的化学性质 金属活动性顺序
试卷更新日期:2021-03-02 类型:一轮复习
一、单选题
-
1. 同学们对金属N的活动性进行探究发现:将金属N放入稀盐酸中,有气泡产生(生成NCl2),将金属N放入ZnSO4溶液中无明显变化。下列化学方程式书写错误的是( )A、 B、 C、 D、2. 下列有关实验及重要现象描述正确的是( )A、镁带在空气中燃烧,发出耀眼的白光 B、铁丝插入稀硫酸中,迅速产生大量气泡,溶液变成浅绿色 C、在空气中加热铝片,铝片立即熔化并剧烈燃烧 D、向氢氧化钠溶液中加入硫酸铜溶液,产生白色沉淀3. 下列图象能正确反映其对应的化学过程的是( )A、硫磺在含有O2的密闭容器中燃烧
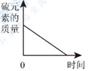 B、等质量的Mg和Zn与足量的等浓度的盐酸反应
B、等质量的Mg和Zn与足量的等浓度的盐酸反应 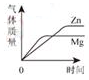 C、加热KMnO4制O2
C、加热KMnO4制O2 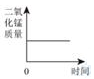 D、两份等质量、等浓度的H2O2溶液分别制取O2
D、两份等质量、等浓度的H2O2溶液分别制取O2 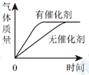 4. 将过量的Fe粉放入含AgNO3和Zn(NO3)2的溶液中,搅拌并充分反应后过滤,滤纸上的金属是( )A、Ag B、Fe、Ag C、Zn、Fe D、Zn、Fe、Ag5. 现有甲、乙、丙三种金属,如果把甲和乙分别放入稀硫酸中,甲溶解并产生H2。乙不反应:如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙的表面有银析出,而丙没有变化,根据以上事实,则甲、乙、丙的金属活动性由强到弱的顺序是( )A、甲>乙>丙 B、乙>甲>丙 C、乙>丙>甲 D、丙>乙>甲6. X、Y、Z是三种二价金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )。
4. 将过量的Fe粉放入含AgNO3和Zn(NO3)2的溶液中,搅拌并充分反应后过滤,滤纸上的金属是( )A、Ag B、Fe、Ag C、Zn、Fe D、Zn、Fe、Ag5. 现有甲、乙、丙三种金属,如果把甲和乙分别放入稀硫酸中,甲溶解并产生H2。乙不反应:如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙的表面有银析出,而丙没有变化,根据以上事实,则甲、乙、丙的金属活动性由强到弱的顺序是( )A、甲>乙>丙 B、乙>甲>丙 C、乙>丙>甲 D、丙>乙>甲6. X、Y、Z是三种二价金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )。①Z+YSO4=ZSO4+Y;
②X+YSO4=XSO4+Y;
③Z+H2SO4=ZSO4+H2↑;
④X+H2SO4→不发生反应。
A、Z>X>Y B、X>Y>Z C、Z>Y>X D、X>Z>Y7. 现有甲、乙、丙三种金属,采用将其中一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如下图所示)。则三种金属的活动性由强到弱的顺序是( )。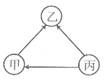 A、乙>甲>丙 B、乙>丙>甲 C、丙>甲>乙 D、丙>乙>甲8. 为了验证铁、锌、铜三种金属的活动性顺序,设计了如下四种方案,其中可行的是( )。A、将Zn、Cu分别加入到FeSO4溶液中 B、将Zn、Fe分别加入到CuSO4溶液中 C、将Zn分别加入到FeSO4、CuSO4溶液中 D、将Cu分别加入到ZnSO4、FeSO4溶液中9. 下列反应属于置换反应的是( )。
A、乙>甲>丙 B、乙>丙>甲 C、丙>甲>乙 D、丙>乙>甲8. 为了验证铁、锌、铜三种金属的活动性顺序,设计了如下四种方案,其中可行的是( )。A、将Zn、Cu分别加入到FeSO4溶液中 B、将Zn、Fe分别加入到CuSO4溶液中 C、将Zn分别加入到FeSO4、CuSO4溶液中 D、将Cu分别加入到ZnSO4、FeSO4溶液中9. 下列反应属于置换反应的是( )。①C+O2 CO2;②CO2+C 2CO;
③Zn+2HCl=ZnCl2+H2↑;④3CO+Fe2O3 2Fe+3CO2;⑤Fe+CuSO4=Cu+FeSO4。
A、①④ B、②③ C、③⑤ D、②④10. 等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图像能正确表示产生氢气质量与反应时间之间关系的是( )A、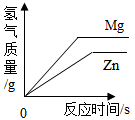 B、
B、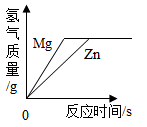 C、
C、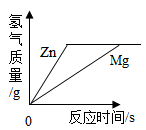 D、
D、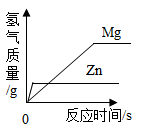 11. 取等质量的X、Y、Z三种金属分别与足量同浓度的稀盐酸反应,都生成+2价盐,反应情况如图,以下叙述正确的是( )
11. 取等质量的X、Y、Z三种金属分别与足量同浓度的稀盐酸反应,都生成+2价盐,反应情况如图,以下叙述正确的是( )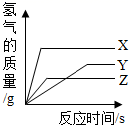 A、金属活动性由强到弱:X>Y>Z B、产生氢气质量:X>Y>Z C、X、Y、Z依次可能是Mg、Zn、Fe D、反应所需时间:X<Y<Z12. 某学习小组同学做完铁与稀硫酸反应实验后,将反应后的混合物M全部倒入盛有一小块铜锌合金的烧杯中,发现有大量气泡产生。待充分反应后过滤,得到滤液和滤渣。他们得出的现象或结论如下:①M中一定不含铁单质;②烧杯中溶液由浅绿色变成蓝色;③滤液中一定含有ZnSO4;④滤渣中可能含有三种金属单质;⑤滤液中可能含有两种金属离子。其中正确的个数有:( )A、4个 B、3个 C、2个 D、1个13. 向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应,过滤。下面对反应结果的判断,错误的是( )A、若反应后溶液为蓝色,滤渣中一定不含有Zn B、若反应后溶液为蓝色,滤渣中一定含有Ag,可能含有Cu C、若反应后溶液为无色,滤渣中一定含有Ag和Cu D、若反应后溶液为无色,滤渣中一定不含有Zn14. 在溶质为Cu(NO3)2、AgNO3和Al(NO3)3的溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和蓝色滤液。下列判断正确的是( )A、向滤渣中加入稀盐酸可能有气泡产生 B、滤渣中一定有Ag,可能有Cu和Zn C、滤液中一定无AgNO3 D、滤液中可能有四种金属离子15. 向AgNO3和Mg(NO3)2的混合溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法正确的是( )A、向滤渣中加入稀盐酸,一定有气泡产生; B、滤渣中一定含有Ag、Fe,一定不含Al; C、滤渣中一定含有Ag,可能含有Fe,一定不含Al; D、滤液中一定含有Fe(NO3)2和Mg(NO3)2 , 一定不含AgNO3 , 可能含有Al(NO3)3。
A、金属活动性由强到弱:X>Y>Z B、产生氢气质量:X>Y>Z C、X、Y、Z依次可能是Mg、Zn、Fe D、反应所需时间:X<Y<Z12. 某学习小组同学做完铁与稀硫酸反应实验后,将反应后的混合物M全部倒入盛有一小块铜锌合金的烧杯中,发现有大量气泡产生。待充分反应后过滤,得到滤液和滤渣。他们得出的现象或结论如下:①M中一定不含铁单质;②烧杯中溶液由浅绿色变成蓝色;③滤液中一定含有ZnSO4;④滤渣中可能含有三种金属单质;⑤滤液中可能含有两种金属离子。其中正确的个数有:( )A、4个 B、3个 C、2个 D、1个13. 向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应,过滤。下面对反应结果的判断,错误的是( )A、若反应后溶液为蓝色,滤渣中一定不含有Zn B、若反应后溶液为蓝色,滤渣中一定含有Ag,可能含有Cu C、若反应后溶液为无色,滤渣中一定含有Ag和Cu D、若反应后溶液为无色,滤渣中一定不含有Zn14. 在溶质为Cu(NO3)2、AgNO3和Al(NO3)3的溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和蓝色滤液。下列判断正确的是( )A、向滤渣中加入稀盐酸可能有气泡产生 B、滤渣中一定有Ag,可能有Cu和Zn C、滤液中一定无AgNO3 D、滤液中可能有四种金属离子15. 向AgNO3和Mg(NO3)2的混合溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法正确的是( )A、向滤渣中加入稀盐酸,一定有气泡产生; B、滤渣中一定含有Ag、Fe,一定不含Al; C、滤渣中一定含有Ag,可能含有Fe,一定不含Al; D、滤液中一定含有Fe(NO3)2和Mg(NO3)2 , 一定不含AgNO3 , 可能含有Al(NO3)3。二、填空题
-
16. 金属制品与我们的日常生活密不可分。(1)、有铝、锌、铜三种金属,其中不能与稀硫酸发生反应的是。(2)、铝的化学性质比较活泼,但铝制品具有很好的抗腐蚀性能,其原因是铝表面容易形成。(3)、为验证Zn、Cu、Ag三种金属的活动性强弱,某同学选用如下试剂组进行验证,其中不合理的一组是(用序号①②③填空)
①Zn、CuSO4溶液、Ag ②ZnSO4溶液、Cu、AgNO3溶液 ③Zn、Cu、AgNO3溶液
(4)、由所学知识可知,活泼性Fe>Cu, 。非金属与金属类似,活泼性Cl2>Br2>l2 , 请写出将Cl2通入NaBr溶液中发生反应的化学方程式。17. 铝是一种比较活泼的常见金属,它与酸、碱溶液都能反应产生氢气。(1)、写出铝与稀硫酸反应的化学方程式:。(2)、完成铝与氢氧化钠溶液反应生成氢气的化学方程式:2Al+2NaOH+═2NaAlO2+3H2↑。(3)、已知NaAlO2与少量盐酸反应的化学方程式:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl.请写出NaAlO2与过量盐酸反应的化学方程式:。三、实验探究题
-
18. 一般情况下,金属活动性越强,与酸反应的速度越快。为了探究金属镁、锌、铁与酸反应的快慢,某研究性学习小组设计了如下的实验。
(实验步骤)
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸。
②分别将过量的、颗粒大小相同的镁、锌、铁三种金属粉末,放入相同的气球中。
③小心的把三个气球分别套在各个试管口上,如图所示。
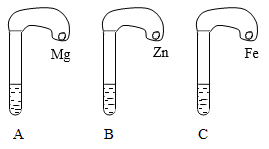
④分别将三种金属粉末倒入试管中。
(实验预测与分析)
(1)、写出锌与盐酸反应的化学方程式。(2)、气球膨胀最快的是。(填“A或B或C”)(3)、铁粉与盐酸反应的现象是。(4)、步骤④是实验获得成功的关键,你认为该操作应该注意的是:。19. 化学知识能够破解某些骗局。骗子常用金光闪闪的“假金元宝”(Cu-Zn合金制成)冒充真金,蒙骗贪小便宣之人。“圳创”小组进行了真假元宝的鉴别。(1)、定性鉴别。下列方法中不能检验金元宝真假的是(填字母,可多选);A.观察外观
B.检测其密度
C.放入MgCl2溶液中
D.在空气中加热
(2)、定量测定。取40g“假金元宝”样品,磨成粉末放入烧杯,将150g一定浓度的稀硫酸分3次加入烧杯中,每次充分反应后,测得剩余固体的质量记录如下表。次数 1 2 3 加入稀硫酸质量/g 50 50 50 剩余固体质量/g 34.8 29.6 27.0 ①第二次实验后剩余29.6g固体的成分是(填字母);
A.CuB. Zn
C.Cu和Zn
②样品中Cu的质量分数为%;
(3)、反应一共生成H2的质量是多少?(写出详细计算过程)(4)、请在下图中绘制出“产生H2的质量”跟“加入稀硫酸的质量”的关系图像。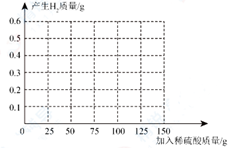
四、综合题
-
20. 我国每年报废的手机超过1亿部。废旧手机的电路板中含有多种金属,随意丢弃会造成资源浪费并污染土壤和水体。某手机电路板中含有铁Fe、锡Sn、铜Cu、银Ag、金Au等金属,如图是某工厂回收其中部分金属的流程图。(其中Sn、Au在化合物中的化合价分别为+2价、+3价)
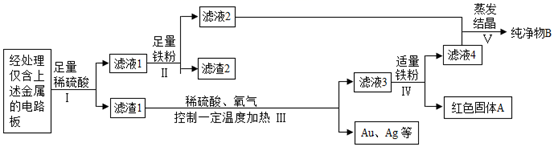 (1)、过程Ⅰ、Ⅲ、Ⅳ均涉及的操作是 , 该操作需要用到一种金属材料制成的仪器是。(2)、写出过程Ⅱ中反应的化学方程式、。(3)、写出过程Ⅲ中反应的化学方程式。(4)、滤液4的主要成分(水除外)是。
(1)、过程Ⅰ、Ⅲ、Ⅳ均涉及的操作是 , 该操作需要用到一种金属材料制成的仪器是。(2)、写出过程Ⅱ中反应的化学方程式、。(3)、写出过程Ⅲ中反应的化学方程式。(4)、滤液4的主要成分(水除外)是。五、计算题
-
21. 取一定量铜粉、铁粉的混合物,加入过量稀硫酸,完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显+2价)。固体质量与各步实验的时间关系如图。
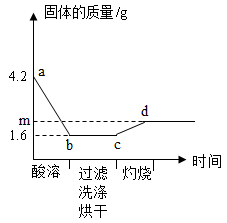 (1)、b点时溶液中溶质的化学式为。(2)、原粉状混合物中铁粉的质量为多少克。(3)、求m的值。(写出计算过程)
(1)、b点时溶液中溶质的化学式为。(2)、原粉状混合物中铁粉的质量为多少克。(3)、求m的值。(写出计算过程)
-