江苏省扬州市邗江区2020年中考化学一模试卷
试卷更新日期:2021-03-01 类型:中考模拟
一、单选题
-
1. 下列属于物理变化的是( )A、水结成冰 B、蜡烛燃烧 C、食物腐败 D、铁锅生锈2. 下列人体所必须的元素中,中老年人缺少会引起骨质疏松的是( )A、锌 B、铁 C、钙 D、钠3. 下列物质分散到水中能形成溶液的是( )A、石灰石 B、植物油 C、高锰酸钾 D、活性炭4. 下列属于合成材料的是( )A、蚕丝 B、聚乙烯 C、金刚石 D、钛合金5. 如图是第115 号镆元素的信息。下列有关说法错误的是( )
 A、镆属于金属元素 B、镆的相对原子质量为288 C、“Mc”表示:镆这种物质、镆元素、1 个镆原子 D、1个镆原子有288个质子6. 下列肥料中属于氮肥的是( )A、KCl B、Ca3(PO4)2 C、NH4HCO3 D、K2CO37. 下列实验操作中,错误的是( )A、
A、镆属于金属元素 B、镆的相对原子质量为288 C、“Mc”表示:镆这种物质、镆元素、1 个镆原子 D、1个镆原子有288个质子6. 下列肥料中属于氮肥的是( )A、KCl B、Ca3(PO4)2 C、NH4HCO3 D、K2CO37. 下列实验操作中,错误的是( )A、 加热液体物质
B、
加热液体物质
B、 读取液体体积
C、
读取液体体积
C、 加入固体粉末
D、
加入固体粉末
D、 倾倒液体物质
8. 格列宁是治疗慢粒白血病的特效药,化学式为C29H31N7O•CH4SO3。下列说法正确的是( )A、格列宁的相对分子质量是589g B、一个格列宁分子中有77个原子 C、格列宁中含有三氧化硫分子 D、格列宁中碳、氢、氧元素的质量比为30:35:49. K2FeO4是一种高效净水剂.其中铁元素的化合价是( )A、+2 B、+3 C、+4 D、+610. 以下是人们在面对“新型冠状病毒肺炎”时的一些认识,你认为符合科学道理的是( )A、家庭使用酒精消毒时,酒精浓度越大消毒效果越好 B、吸烟、喝酒可以预防“新型冠状病毒” C、勤开窗通风有利于防治新冠肺炎等传染性疾病 D、健康人可以服用药物双黄连预防新冠肺炎11. 防止垃圾污染环境,分类回收是关键,下图表示可回收标志的是( )A、
倾倒液体物质
8. 格列宁是治疗慢粒白血病的特效药,化学式为C29H31N7O•CH4SO3。下列说法正确的是( )A、格列宁的相对分子质量是589g B、一个格列宁分子中有77个原子 C、格列宁中含有三氧化硫分子 D、格列宁中碳、氢、氧元素的质量比为30:35:49. K2FeO4是一种高效净水剂.其中铁元素的化合价是( )A、+2 B、+3 C、+4 D、+610. 以下是人们在面对“新型冠状病毒肺炎”时的一些认识,你认为符合科学道理的是( )A、家庭使用酒精消毒时,酒精浓度越大消毒效果越好 B、吸烟、喝酒可以预防“新型冠状病毒” C、勤开窗通风有利于防治新冠肺炎等传染性疾病 D、健康人可以服用药物双黄连预防新冠肺炎11. 防止垃圾污染环境,分类回收是关键,下图表示可回收标志的是( )A、 B、
B、 C、
C、 D、
D、 12. 下列实验现象的描述错误的是( )A、干冰放置在空气中周围有白雾 B、铜丝在空气中加热表面变黑 C、硫酸铜溶液能与氢氧化钠溶液反应产生白色沉淀 D、氨气遇到湿润的红色石蕊试纸,试纸变蓝13. 下列物质由离子构成的是( )A、NaCl B、CH4 C、CO2 D、Au14. 某种催化剂可将尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分。根据该反应的微观示意图,分析下列说法正确的是( )
12. 下列实验现象的描述错误的是( )A、干冰放置在空气中周围有白雾 B、铜丝在空气中加热表面变黑 C、硫酸铜溶液能与氢氧化钠溶液反应产生白色沉淀 D、氨气遇到湿润的红色石蕊试纸,试纸变蓝13. 下列物质由离子构成的是( )A、NaCl B、CH4 C、CO2 D、Au14. 某种催化剂可将尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分。根据该反应的微观示意图,分析下列说法正确的是( ) A、四种物质均属于化合物 B、生成丙和丁的质量比为11:7 C、参加反应的甲和乙的质量比为23:28 D、丁分子的微观示意图为
A、四种物质均属于化合物 B、生成丙和丁的质量比为11:7 C、参加反应的甲和乙的质量比为23:28 D、丁分子的微观示意图为 15. 实验小组用传感器研究等量水或NaOH溶液分别吸收CO2的效果,实验装置及测定结果如下图所示。下列说法错误的是()
15. 实验小组用传感器研究等量水或NaOH溶液分别吸收CO2的效果,实验装置及测定结果如下图所示。下列说法错误的是()
 A、曲线①是CO2溶解和CO2与水反应的综合结果 B、对比曲线①和②,可说明CO2能与NaOH反应 C、NaOH溶液吸收CO2的效果比水好 D、若选用等量饱和石灰水进行实验,其曲线在①上方16. 下列有关说法正确的是( )A、用钢丝球经常擦洗铝锅 B、洗洁精能清洗油污,可以溶解油污 C、煤、石油和天然气贮量有限,都是不可再生能源 D、长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用17. 如图为A、B、C三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A、曲线①是CO2溶解和CO2与水反应的综合结果 B、对比曲线①和②,可说明CO2能与NaOH反应 C、NaOH溶液吸收CO2的效果比水好 D、若选用等量饱和石灰水进行实验,其曲线在①上方16. 下列有关说法正确的是( )A、用钢丝球经常擦洗铝锅 B、洗洁精能清洗油污,可以溶解油污 C、煤、石油和天然气贮量有限,都是不可再生能源 D、长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用17. 如图为A、B、C三种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( ) A、t1℃时,A,C两种物质饱和溶液中含有的溶质质量一定相同 B、t1℃时,A溶液溶质质量分数为20% C、t2℃的三种物质的饱和溶液降温到t1℃时,溶质质量分数由大到小的顺序为B>A=C D、t1℃时,125gA物质的饱和溶液加水稀释可以得到250g质量分数10%的A物质的溶液18. 工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图
A、t1℃时,A,C两种物质饱和溶液中含有的溶质质量一定相同 B、t1℃时,A溶液溶质质量分数为20% C、t2℃的三种物质的饱和溶液降温到t1℃时,溶质质量分数由大到小的顺序为B>A=C D、t1℃时,125gA物质的饱和溶液加水稀释可以得到250g质量分数10%的A物质的溶液18. 工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图
下列说法错误的是( )
A、“转化”时在溶液中生成了FeCO3沉淀,该反应的基本反应类型是复分解反应 B、“过滤”后得到的滤液中的溶质只有(NH4)2SO4 C、“干燥”过程中有少量的FeCO3转化为FeOOH和CO2 , 此时与FeCO3反应的物质有O2和H2O D、取14.06g还原铁粉(仅含有Fe和少量FexC)在氧气流中充分加热,得到0.22gCO2 , 另取相同质量的还原铁粉与足量稀硫酸充分反应(FexC与稀硫酸不反应),得到0.48gH2 , 则FexC的化学式是Fe2C二、多选题
-
19. 下列实验操作中不能达到实验目的是( )
选项
物质
主要实验操作
A
鉴别NH4NO3固体和NaOH固体
分别加水溶解,测溶液的温度变化
B
除去CO2中混有少量CO
通入O2 , 点燃
C
检验加碘盐中是否含有碘
加入淀粉溶液,看是否变蓝
D
除去FeSO4溶液中的CuSO4
加入过量的铁粉,过滤
A、A B、B C、C D、D20. 下列图象能正确反映对应变化关系的是( )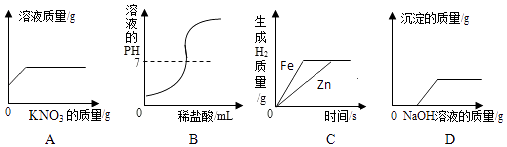 A、在一定温度下,向不饱和的硝酸钾溶液中加入硝酸钾固体,充分搅拌 B、向NaOH溶液中逐滴加入稀盐酸 C、将一定质量的稀盐酸平均分为两份,分别向其中加入足量的金属Zn和Fe D、在一定量CuCl2和HCl溶液中逐滴加入NaOH溶液
A、在一定温度下,向不饱和的硝酸钾溶液中加入硝酸钾固体,充分搅拌 B、向NaOH溶液中逐滴加入稀盐酸 C、将一定质量的稀盐酸平均分为两份,分别向其中加入足量的金属Zn和Fe D、在一定量CuCl2和HCl溶液中逐滴加入NaOH溶液三、填空题
-
21. 化学在人体保健、医疗卫生生活生产等方面作出了重大贡献。请用所学的化学知识解答有关问题:(1)、常用的消毒剂有双氧水(其有效成分化学式为);84消毒液主要成分为次氯酸钠(NaClO),写出84消毒液中的2种离子的离子符号和。84消毒液在抗击疫情中起了重大重用,但不可和消毒酒精混合使用,混合时会生成有毒的氯气,写出氯气的化学式。(2)、酒精通常以乙醇为主,使得病毒蛋白质变性和脂质膜溶解。消毒酒精在一定条件下使用不当也会引起火灾,写出酒精燃烧的化学方程式。(3)、铅蓄电池在生产、生活中使用广泛。
①铅蓄电池充电时是将电能转化为(填序号);
a 机械能 b 热能 c 化学能
②用98%的浓硫酸配制5%的稀硫酸100克,为准确量取浓硫酸的体积,还需查阅的数据是;
③铅蓄电池的工作原理可以表示为:2PbSO4+2H2O Pb+PbO2+2请将方程式补充完整.据此可知,铅蓄电池在充电时,溶液pH将不断(填“增大”、“减小”或“不变”)。
(4)、SO2是大气污染物之一,大气中二氧化硫浓度大时,能形成酸雨,酸雨的pH<。为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如图所示实验装置。
①检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后拉动注射器活塞,观察到玻璃管下端 , 则证明该装置的气密性良好。
②向试管中加入一定浓度一定质量的稀高锰酸钾溶液,测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气;观察到溶液由恰好时反应恰好完全进行,此时停止抽气。
③二氧化硫含量高原因可能是冬季燃煤取暖多,同学们提出建议在煤中掺熟石灰吸收煤燃烧产生的二氧化硫,写出该反应原理的化学方程式。
四、科学探究题
-
22. “疫情过后,人人都是面点大师!”火龙果味甜多汁,营养丰富、功能独特。某同学在今年寒假居家期间尝试用红心火龙果汁、发酵粉(主要成分为碳酸氢钠和酒石酸)和面粉制作“紫红色花卷”。
 (1)、碳酸氢钠的俗称是。(2)、自制紫红色花卷时,需在面粉中加入一定量的红心火龙果汁,比普通花卷多提供的营养素主要是矿物质和。花卷中能提供能量的物质是。(3)、蒸熟后,却发现花卷变成了黄色。他们对此进行了探究。
(1)、碳酸氢钠的俗称是。(2)、自制紫红色花卷时,需在面粉中加入一定量的红心火龙果汁,比普通花卷多提供的营养素主要是矿物质和。花卷中能提供能量的物质是。(3)、蒸熟后,却发现花卷变成了黄色。他们对此进行了探究。(查阅资料)①心火龙果汁含天然色素,呈紫红色,受热易分解。
②发酵粉主要成分是碳酸氢钠,受热分解生成碳酸钠、水和二氧化碳
(猜想与假设)
Ⅰ.紫红色花卷变黄与温度升高有关 Ⅱ.紫红色花卷变黄与发酵粉有关
实验1:探究影响紫红色花卷变黄的因素。
序号
1-1
1-2
1-3
1-4
用品
红心火龙果汁、面粉
红心火龙果汁、
面粉
红心火龙果汁、
面粉、发酵粉
红心火龙果汁、
面粉、发酵粉
操作
加热
不加热
加热
不加热
现象
从紫红变红棕色
仍为紫红色
从紫红变黄色
仍为紫红色
实验1-1出现“紫红色变红棕色”的原因是。
实验2:继续探究实验1-3中花卷变黄的原因。
序号
2-1
2-2
2-3
实验过程
10 mL NaHCO3溶液
pH=8
红心火龙果汁
10 mL Na2CO3溶液
pH=10
红心火龙果汁
10 mL Na2CO3溶液
调至pH=12
红心火龙果汁
现象
颜色无明显变化
一段时间后变黄色
较短时间后变黄色
(4)、写出碳酸氢钠受热分解的化学方程式:。(5)、综合分析实验1、2,蒸熟后,发现花卷变成了黄色的原因是。(6)、通过实验探究和查阅资料,该同学发现酵母可以代替发酵粉进行发面,决定使用酵母,制作紫红色花卷。花卷中含有硒和钙等矿物质,其中属于微量元素是(填元素符号)。23. CCTV1撒贝宁主持的《加油向未来》做过这样一个实验,专业人员将大块的钠扔入水中瞬间产生爆炸。小耿同学看到该节目后,他对钠产生了强烈的好奇。(查阅资料)
①钠是一种活泼金属,常温下不与煤油反应,能与氧气、水,二氧化碳等物质发生反应。与水剧烈反应能生成一种可燃性气体与一种碱。
②密度:煤油0.8g/cm3 , 水1g/cm3 , 钠0.97g/cm3。钠一般保存在煤油中。
(实验探究)
老师启发下,小耿同学设计了如图1所示的一套钠与水反应的实验装置(夹持仪器已略)。
(实验步骤)①检查装置气密性;
②向大试管中加入一定体积煤油;
③用小刀切一小块钠,放入大试管,塞上橡皮塞;
④打开活塞,通过长颈漏斗向试管中加入水。使煤油的液面升至胶塞,关闭活塞观察现象。

请回答下列问题:
(1)、金属钠保存在煤油中的原因是(2)、图1中,仪器X的名称是(3)、实验结束打开活塞,将燃着的木条放到尖嘴处,发现气体被点燃,产生色火焰,罩一个干冷的烧杯在火焰上方,烧杯内壁有水雾,生成的气体是(填化学式)。小季同学将图1试管中的水换成足量的硫酸铜溶液,观察到产生了气泡和一种蓝色沉淀。没有看到有红色的铜生成,根据实验探究和查阅资料了解到,金属钠先与硫酸铜溶液中的水反应,其化学方程式为。小杨在实验室中探究金属钠与二氧化碳的反应,选用如图2所示装置及药品进行实验。回答下列问题:
(4)、打开活塞,制取CO2 , 实验室制取二氧化碳的化学方程式。为了得到干燥、纯净的CO2 , B中盛有(填试剂名称)溶液。反应结束后,关闭活塞,干燥管内可观察到的现象是。用稀硫酸(填“能”或者“不能”)代替稀盐酸。(5)、金属钠与二氧化碳反应的实验步骤及现象如下表:操作步骤
实验现象
1
打开活塞,待玻璃管中充满二氧化碳后,点燃酒精灯加热。
产生大量白烟,玻璃管壁上有黑色固体产生。
2
冷却后,将玻璃管中的固体全部取出,并置于试管中,加入适量的蒸馏水,振荡、过滤。
滤纸上留下黑色物质,滤液为无色溶液
①验证玻璃管中充满二氧化碳的方法是 。
②为检验玻璃管中白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红;向第二支试管中滴加氢氧化钡溶液,溶液变浑浊。据此推断,白色物质中一定有的物质的化学式是(填标号)。
A Na2O B Na2O2 C NaOH D Na2CO3
③经检验,滤纸上留下的黑色固体是一种单质,请写出它能与其他黑色固体反应的化学方程式:(任写一个)。
④本实验中金属钠与二氧化碳反应的化学方程式为 。
24. 目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。(1)、Ⅰ.(镍粉制备):工业用电解镍新液(主要含NiSO4、NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],并利用其制备镍粉的流程如下:

反应器中的一个重要反应为3NiSO4 + 3Na2CO3 + 2H2O = NiCO3·2Ni(OH)2 +3Na2SO4 + 2CO2↑,生成的气体直接排放对环境的影响是。
(2)、物料在反应器中反应时需要控制反应条件。

分析上图,反应器中最适合的温度及pH分别为、8.3。
(3)、生产中,pH逐渐增加,生成Ni(OH)2含量也相对增加,则生成的碱式碳酸镍晶体中,镍的含量将(填“升高”、“降低”或“不变”)。(4)、操作2含过滤、水洗、95%酒精浸泡、晾干等操作。其中使用95%酒精浸泡的目的是(5)、Ⅱ.(测定碱式碳酸镍晶体的组成):为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如下实验方案及装置:

(资料卡片)
①碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
②碱石灰是NaOH和CaO的混合物,可以吸收CO2和H2O
(实验步骤)
①检查装置气密性;②准确称取7.54g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)。
装置C/g
装置D/g
装置E/g
加热前
250.00
190.00
190.00
加热后
252.16
190.88
190.00
(实验分析及数据处理)
实验过程中步骤③鼓入空气的目的是。装置A的作用是。
(6)、计算7.54g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]完全分解中镍元素的质量。最终通过计算得到了碱式碳酸镍晶体的组成,x:y:z=(7)、(实验反思)另一小组同学加热时在酒精灯上加了铁丝网罩,实验结束后,称得装置B中残留固体质量明显偏大。经查阅资料发现:在温度控制不当导致温度过高时,NiO会部分被氧化成Ni2O3。 该组同学称得的残留固体混合物的质量可能是。
A 4.5g B 4.6g C 4.98g D 5.2g
五、流程题
-
25. 工业上用菱锰矿[主要成分为MnCO3 , 含FeCO3、Cu2(OH)2CO3、SiO2等杂质]为原料来制取二氧化锰,其生产流程示意图如下:

回答下列问题:
(1)、加盐酸之前,需要将菱锰矿粉碎,目的是(2)、操作②是 , 此操作过程中用的玻璃仪器有玻璃棒、、 , 其中玻璃棒的作用是。(3)、向菱锰矿中加入盐酸,MnCO3、FeCO3、Cu2(OH)2CO3都溶解并转化为MnCl2、FeCl2、CuCl2。盐酸与MnCO3反应的化学方程式为。滤渣1主要成分是二氧化硅,需要洗涤,洗涤的目的是 , 可以通过在最后一次洗涤液中滴加(填化学式)溶液,若无明显现象,则已洗涤干净。(4)、加入双氧水将铁元素转化为Fe(OH)3沉淀,其反应为:2FeCl2 + H2O2 + 4H2O = 2Fe(OH)3↓ + 4HCl,该反应化合价发生变化的元素是氧和(填元素名称)。(5)、加入Na2S、MnS等硫化物,均可将MnCl2中混有的CuCl2转化为CuS沉淀除去,但实际生产中选用MnS,其原因是。
-