山西省晋中市平遥县2019年中考化学4月模拟试卷
试卷更新日期:2021-03-01 类型:中考模拟
一、选择题(每小题2分,共20分.每小题只有一个选项符合题意)
-
1. 下列变化中属于物理变化的是( )A、铁矿石炼铁 B、粮食酿酒 C、二氧化碳制干冰 D、纯碱制烧碱2. 规范的实验操作是实验成功的保证。下列实验操作错误的是( )A、
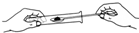 加入固体粉末
B、
加入固体粉末
B、 读取液体体积
C、
读取液体体积
C、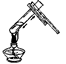 加热液体物质
D、
加热液体物质
D、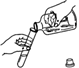 倾倒液体物质
3. 染发时常用到的着色剂﹣﹣对苯二胺,是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其化学式为C6H8N2 . 下列有关对苯二胺的说法正确的是( )A、对苯二胺是化合物 B、对苯二胺的相对分子质量为27 C、对苯二胺中碳、氢、氮元素的质量比为3:4:1 D、对苯二胺能被人体少量吸收4. 下列处理方法错误的是( )A、浓硫酸沾到皮肤上,立即用大量水冲洗 B、图书馆着火,用二氧化碳灭火器灭火 C、用点火法检查厨房内天然气是否泄漏 D、进入久未开启的菜窖前,用燃着的蜡烛试验5. 如图是a、b、c三种物质的溶解度曲线图,现有一定温度下的a、b、c的不饱和溶液,分别通过增加溶质、蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是( )
倾倒液体物质
3. 染发时常用到的着色剂﹣﹣对苯二胺,是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其化学式为C6H8N2 . 下列有关对苯二胺的说法正确的是( )A、对苯二胺是化合物 B、对苯二胺的相对分子质量为27 C、对苯二胺中碳、氢、氮元素的质量比为3:4:1 D、对苯二胺能被人体少量吸收4. 下列处理方法错误的是( )A、浓硫酸沾到皮肤上,立即用大量水冲洗 B、图书馆着火,用二氧化碳灭火器灭火 C、用点火法检查厨房内天然气是否泄漏 D、进入久未开启的菜窖前,用燃着的蜡烛试验5. 如图是a、b、c三种物质的溶解度曲线图,现有一定温度下的a、b、c的不饱和溶液,分别通过增加溶质、蒸发溶剂或升高温度三种方法,均可变成饱和溶液的是( ) A、a溶液 B、b溶液 C、c溶液 D、a溶液和c溶液6. 金属钛(Ti)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料.某化学兴趣小组在实验室探究Ti、Mg、Cu的活泼性顺序,他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度足量稀盐酸中,观察现象如下:
A、a溶液 B、b溶液 C、c溶液 D、a溶液和c溶液6. 金属钛(Ti)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料.某化学兴趣小组在实验室探究Ti、Mg、Cu的活泼性顺序,他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度足量稀盐酸中,观察现象如下:金属
Ti
Mg
Cu
金属表面现象
放出气泡速度缓慢
放出气泡速度快
无变化
下列有关三种金属的说法正确的是( )
A、三种金属的活泼性由强到弱的顺序是:Ti、Mg、Cu B、若Ti粉中混有Mg,提纯Ti时可用稀盐酸除去Mg C、用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径 D、温度、金属表面积、盐酸浓度等因素都会影响反应速率7. 下列离子在水中能大量共存,并形成无色溶液的是( )A、Fe3+、Na+、NO3﹣、Cl﹣ B、K+、Na+、Al3+、SO42﹣ C、H+、K+、SO42﹣、OH﹣ D、Mg2+、NO3﹣、OH﹣、Cl﹣8. 下列图象能正确反映对应变化关系的是( ) A、两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气 B、加水稀释浓盐酸 C、向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液 D、将足量粉末状的铁和镁分别与等质量,等质量分数的稀盐酸反应9. 分析推理是化学学习中最常用的思维方法,下列说法正确的是( )A、元素是指具有相同质子数的一类原子的总称,具有相同质子数的粒子一定是同种元素 B、单质是由同种元素组成的物质,由同种元素组成的物质不一定是单质 C、碱溶液的pH大于7,pH大于7的溶液一定是碱溶液 D、氧化物中一定含有氧元素,含氧元素的化合物一定是氧化物10. 下列除去杂质的方法正确的是( )
A、两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气 B、加水稀释浓盐酸 C、向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液 D、将足量粉末状的铁和镁分别与等质量,等质量分数的稀盐酸反应9. 分析推理是化学学习中最常用的思维方法,下列说法正确的是( )A、元素是指具有相同质子数的一类原子的总称,具有相同质子数的粒子一定是同种元素 B、单质是由同种元素组成的物质,由同种元素组成的物质不一定是单质 C、碱溶液的pH大于7,pH大于7的溶液一定是碱溶液 D、氧化物中一定含有氧元素,含氧元素的化合物一定是氧化物10. 下列除去杂质的方法正确的是( )选项
物质
杂质
除杂质的方法
A
CaCl2溶液
稀盐酸
加入过量的CaCO3、过滤
B
盐酸
硫酸
加入过量的BaCl2溶液、过滤
C
NaNO3
NaCl
加入过量的AgNO3溶液、过滤
D
CaO
Ca(OH)2
加过量水,过滤
A、A B、B C、C D、D二、生活生产应用题(化学方程式每空2分,其余每空1分,共14分)
-
11. 学习化学能使我们更好地认识生活中的有关现象,更合理地解决实际问题.(1)、铝和铜常用于制造电线,是用到了铝和铜的性.(2)、衣服上沾上了较多的油污时,可用汽油洗去的原因是 .(3)、增大物质溶解度的方法是 .(4)、25m3的石油气在加压的情况下可装入容积0.024m3的钢瓶中,原因是 .12. 化学物质及其变化与人类生产、生活密切相关.(1)、目前,一些发达国家已基本采用新一代饮用水消毒剂二氧化氯.二氧化氯中氯元素的化合价为 .(2)、电镀或焊接前,常用稀盐酸除去铁制品表面的铁锈(主要成分为Fe2O3).用化学方程式表示其反应原理
.
(3)、某食品的包装袋内,有一个装有白色颗粒状固体的小纸袋.上面写着“干燥剂,主要成分是生石灰,请勿食用”.生石灰起干燥作用时发生反应的化学方程式为 , 该反应的基本类型为 .13. 粗盐提纯是初中化学中重要的实验,某校老师引导学生做完实验后,在课后的拓展练习中设计了如下习题,请大家完成。(1)、实验室除去粗盐中泥沙等难溶性杂质的实验步骤如图:
①操作I的名称是。
②在蒸发过程中,用到的玻璃仪器有。
(2)、工业上制备粗盐时,通过晒盐或煮盐的方法,可以蒸发盐溶液中水分使之浓缩结晶,理由是。(3)、由于粗盐中含有少量MgCl2等杂质,不能满足化工生产的要求。因此必须将粗盐进行精制。除去粗盐中的MgCl2所发生的反应的方程式为。三、科普阅读题(每空1分,共5分)
-
14. 硫酸铜为白色或灰白色粉末,吸水性很强,吸水后反应生成蓝色的五水合硫酸铜[Cu(H2O)4]SO4•H2O或CuSO4•5H2O],其水溶液因水合铜离子的缘故而呈现出蓝色,故在实验室里无水硫酸铜常被用于检验水的存在。硫酸铜常见的形态为蓝色晶体,即五水合硫酸铜,俗称胆矾或蓝矾,它并不稳定,在加热的条件下,逐渐失去结晶水而变成硫酸铜粉末,给硫酸铜粉末继续加热至650℃高温,可分解为黑色氧化铜、二氧化硫及氧气。
硫酸铜有广泛的应用,如:工业上可用于电镀、定氨催化剂,无水硫酸铜用作脱水剂和气体干燥剂;农业上可与熟石灰混合制农药波尔多液,用于杀菌剂;医疗上可用于检测贫血及作催吐剂。硫酸铜可以通过不同种方法制得,比如,下面的方法便可以制取硫酸铜。

硫酸铜属于重金属盐,有毒,对于人和动物都可因误食一定量而导致死亡,所以用量必须严格控制,若误食,应立即大量食用牛奶、鸡蛋清等富含蛋白质食品,或者使用EDTA钙钠盐解毒。
(1)、无水硫酸铜检验水存在的颜色变化是。(2)、写出一种能制得硫酸铜的化学反应方程式。(3)、在制备硫酸铜流程中,过滤后的溶液是硫酸铜溶液(填“饱和”或“不饱和”)(4)、关于硫酸铜说法错误的是 。A、五水合硫酸铜的相对分子质量是250. B、胆矾的化学性质不稳定。 C、无水硫酸铜可作气体干燥剂。 D、硫酸铜的水溶液也称作为波尔多液。四、物质组成与变化分析题(化学方程式每空2分,其余每空1分,共8分)
-
15. 水消毒过程中常会发生如下化学反应,其反应的微观过程可用如图表示:(“O”表示氧原子,“●”表示氢原子,“
 ”表示氯原子)
”表示氯原子)  (1)、上述图中所出现的物质中,共有种含有氧元素的化合物。(2)、从图中我们可知,在化学反应中,反应前后个数不变。(3)、写出图一发生反应的化学方程式。16. A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种。它们之间的反应或转化关系如图(部分物质和反应条件已略去)。
(1)、上述图中所出现的物质中,共有种含有氧元素的化合物。(2)、从图中我们可知,在化学反应中,反应前后个数不变。(3)、写出图一发生反应的化学方程式。16. A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种。它们之间的反应或转化关系如图(部分物质和反应条件已略去)。
则:
(1)、B的化学式是:。(2)、C的化学式是。(3)、A跟C反应的基本反应类型是。(4)、A在农业生产中的用途是。五、探究题(化学方程式每空2分,其余每空1分,共17分)
-
17. 请你根据所学知识并结合如图所示装置回答有关问题:
 (1)、指出标号①仪器的名称:。(2)、用高锰酸钾制取氧气应选择的发生装置是 , (填序号)可以用E装置收集氧气的原因是 , 当观察到现象时,说明氧气已收满;集满氧气的集气瓶应(填“正”或“倒”)放在桌面上。(3)、实验室欲制取干燥的二氧化碳,需将气体通过盛有(填药品名称)的洗气瓶F。(4)、用收集到的氧气和二氧化碳分别完成如图G、H所示实验,G中集气瓶底部盛有少量水的原因是18. 课本第二单元课题3制取氧气,课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探究方案。
(1)、指出标号①仪器的名称:。(2)、用高锰酸钾制取氧气应选择的发生装置是 , (填序号)可以用E装置收集氧气的原因是 , 当观察到现象时,说明氧气已收满;集满氧气的集气瓶应(填“正”或“倒”)放在桌面上。(3)、实验室欲制取干燥的二氧化碳,需将气体通过盛有(填药品名称)的洗气瓶F。(4)、用收集到的氧气和二氧化碳分别完成如图G、H所示实验,G中集气瓶底部盛有少量水的原因是18. 课本第二单元课题3制取氧气,课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探究方案。【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤
实验现象
实验结论及解释
Ⅰ.

A中无明显现象,B中产生大量能使带火星木条复燃的气体
①产生的气体是
②红砖粉末能改变过氧化氢分解速率
Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣
①又产生大量能使带火星木条复燃的气体
②滤渣质量等于ag
红砖粉末的和在反应前后均没有发生变化,能作过氧化氢分解的催化剂
Ⅲ.

两试管中均产生气泡
不同之处是
红砖粉末的催化效果没有二氧化锰粉末好
19. 某同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖.对于该溶液是否变质,同学们开始实验探究.【猜想假设】
猜想(1):该溶液没有变质,为NaOH溶液.
猜想(2):该溶液全部变质,为Na2CO3溶液.
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液.
【查阅资料】Na2CO3溶液呈碱性
(1)、【设计方案】请你完善下表几组同学探讨的设计方案实验操作
可能出现的现象与结论
同学评价
第1组

若溶液变红,则猜想(2)不成立
第2组同学认为:此方案结论不正确,理由是: .
第2组

若产生白色沉淀,反应方程式是:
则猜想(1)不成立.
第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立.
第3组

若滤液不变红,则猜想(2)成立;若滤液变红,则猜想(3)成立.
第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是:
(2)、【探究实验】综合各小组的方案后,动手实验.【结论与反思】NaOH溶液易与空气中反应而变质,为防止变质,所以保存时要 .
第二组实验中,产生沉淀的方程式为: .
六、计算题(共6分)
-
20. 正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。(1)、正常情况下,人的胃液显性。(2)、人的胃液总量为100mL,正常人胃液中HCl的质量范围是g。(3)、服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是。(4)、医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)
-