初中化学第一轮复习第一部分 考点6 溶液
试卷更新日期:2021-03-01 类型:一轮复习
一、单选题
-
1. 小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是( )
温度/℃
0
10
20
40
60
80
100
溶解度/g
182
191
204
238
287
362
487
A、配制的蔗糖溶液下层比上层甜 B、降温,糖水中一定有晶体析出 C、20℃时,蔗糖饱和溶液质量一定为304g D、升温,糖水中蔗糖的质量分数不变2. 温度不变,对100mL氯化钠饱和溶液进行如图所示实验。下列结论错误的是( )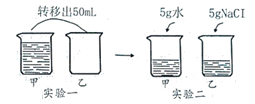 A、实验二后,乙溶液溶质质量分数增大 B、实验一后,甲和乙中溶质质量分数相等 C、实验二后,甲溶液变为不饱和溶液 D、实验二后,甲和乙溶液中溶质质量相等3. 如图是a、b两种固体物质的溶解度曲线。下列说法中错误的是( )
A、实验二后,乙溶液溶质质量分数增大 B、实验一后,甲和乙中溶质质量分数相等 C、实验二后,甲溶液变为不饱和溶液 D、实验二后,甲和乙溶液中溶质质量相等3. 如图是a、b两种固体物质的溶解度曲线。下列说法中错误的是( )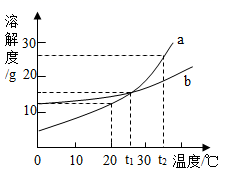 A、a、b两种物质都属于易溶性物质 B、t2℃时,将a、b的饱和溶液分别降温到t1℃时,析出的晶体的质量a比b多 C、t1℃时,a、b两种物质饱和溶液中溶质的质量分数相等 D、当a中含有少量b时,可以用降温结晶法提纯a4. 甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )
A、a、b两种物质都属于易溶性物质 B、t2℃时,将a、b的饱和溶液分别降温到t1℃时,析出的晶体的质量a比b多 C、t1℃时,a、b两种物质饱和溶液中溶质的质量分数相等 D、当a中含有少量b时,可以用降温结晶法提纯a4. 甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )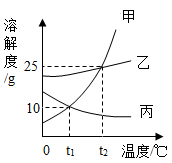 A、蒸发足量的溶剂一定可使丙的不饱和溶液变为饱和溶液 B、将t1℃,55g甲的饱和溶液升温至t2℃时刚好成饱和溶液 C、t1℃时,等质量的甲、乙、丙三种溶液所含溶质的质量大小顺序一定为乙>甲=丙 D、t2℃时,甲、乙、丙的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数大小顺序一定为乙>甲=丙5. 下列关于溶液的说法,错误的是( )A、溶液各部分性质相同,是一种高级混合物 B、氯化钠的饱和溶液不能再继续溶解氯化钠,但可以继续溶解硝酸钾等其他溶质 C、接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态 D、20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液含有氯化钠36g6. 如图是A、B、C三种固体物质的溶解度曲线图,下列说法错误的是( )
A、蒸发足量的溶剂一定可使丙的不饱和溶液变为饱和溶液 B、将t1℃,55g甲的饱和溶液升温至t2℃时刚好成饱和溶液 C、t1℃时,等质量的甲、乙、丙三种溶液所含溶质的质量大小顺序一定为乙>甲=丙 D、t2℃时,甲、乙、丙的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数大小顺序一定为乙>甲=丙5. 下列关于溶液的说法,错误的是( )A、溶液各部分性质相同,是一种高级混合物 B、氯化钠的饱和溶液不能再继续溶解氯化钠,但可以继续溶解硝酸钾等其他溶质 C、接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态 D、20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液含有氯化钠36g6. 如图是A、B、C三种固体物质的溶解度曲线图,下列说法错误的是( )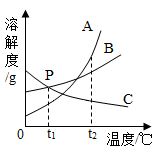 A、t2℃时,A,B,C三种物质中,A物质的溶解度最大 B、P点表示t1℃时B,C两物质的溶解度大小相等 C、20℃时,给A,B,C三种物质的饱和溶液加热(不考虑溶剂的蒸发),有晶体析出的是A物质 D、从A,B的混合物中提纯A应采用降温结晶法7. 下列叙述正确的是( )A、溶液具有均一性和稳定性是因为溶液中的各种粒子都静止不动 B、用洗洁精清洗餐具上的油污,利用的是乳化作用 C、升温可以使所有物质的饱和溶液变为不饱和溶液 D、溶质均以离子形式分散到溶剂中8. 下列关于溶液说法正确的是( )A、将氯化钠和植物油放入水中,充分搅拌后都能形成溶液 B、把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10% C、向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解 D、配制50g16%的氯化钠溶液首先要计算所需氯化钠和水的质量9. 按如图所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。若液体X是水,则固体y可能是( )
A、t2℃时,A,B,C三种物质中,A物质的溶解度最大 B、P点表示t1℃时B,C两物质的溶解度大小相等 C、20℃时,给A,B,C三种物质的饱和溶液加热(不考虑溶剂的蒸发),有晶体析出的是A物质 D、从A,B的混合物中提纯A应采用降温结晶法7. 下列叙述正确的是( )A、溶液具有均一性和稳定性是因为溶液中的各种粒子都静止不动 B、用洗洁精清洗餐具上的油污,利用的是乳化作用 C、升温可以使所有物质的饱和溶液变为不饱和溶液 D、溶质均以离子形式分散到溶剂中8. 下列关于溶液说法正确的是( )A、将氯化钠和植物油放入水中,充分搅拌后都能形成溶液 B、把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10% C、向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解 D、配制50g16%的氯化钠溶液首先要计算所需氯化钠和水的质量9. 按如图所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。若液体X是水,则固体y可能是( )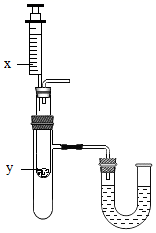 A、氢氧化钠 B、氯化钠 C、硝酸铵 D、二氧化锰10. 根据实验判断下列说法错误的是( )
A、氢氧化钠 B、氯化钠 C、硝酸铵 D、二氧化锰10. 根据实验判断下列说法错误的是( )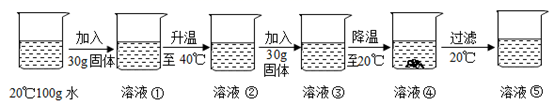 A、溶液①和溶液②中溶质的质量分数相同,但均小于溶液③ B、溶液③可能是饱和溶液 C、溶液④的溶质质量分数大于溶液⑤的溶质质量分数 D、溶液中溶剂质量:①=②=③=④=⑤11. 能证明硝酸钾在20℃时已达到饱和状态的是( )A、取少量该溶液,升温后没有硝酸钾晶体析出 B、温度不变,向该溶液中加入少量水,溶质的质量分数变小 C、温度不变,向该溶液加入少量硝酸钾晶体,溶质质量分数不变 D、取少量该溶液,降温到10℃,有硝酸钾晶体析出12. 大地震后,为防止疾病传染,需对灾区喷洒消毒剂,进行医疗卫生防疫。质量分数为0.2%~1%的过氧乙酸就是用于环境喷洒和用具浸泡的一种消毒剂。现有市售质量分数为20%的过氧乙酸,要配制1%的过氧乙酸10kg,需要市售过氧乙酸的质量为( )A、1000g B、500g C、100g D、50g13. 有40g5%的硝酸钾溶液,若将其质量分数增大到10%,应采用的方法是 ( )A、把溶剂蒸发掉一半 B、加入40g溶质质量分数为15%的硝酸钾溶液 C、把溶液倒掉20g D、加入2g硝酸钾固体14. 下列实验数据分析合理的是( )A、向H2O2溶液中加入5gMnO2 , 充分反应后MnO2的质量仍为5g B、将5g NaCl溶解在100g水中,得到溶液中NaCl的质量分数为5% C、 D、使5g Mg完全燃烧后,生成物的质量仍为5g15. 现有M、N两物质在室温下的饱和溶液,升温后,M溶液有晶体析出,而N溶液还可以再溶解N晶体,则能符合题意表示M、N两种物质溶解度曲线的是( )A、
A、溶液①和溶液②中溶质的质量分数相同,但均小于溶液③ B、溶液③可能是饱和溶液 C、溶液④的溶质质量分数大于溶液⑤的溶质质量分数 D、溶液中溶剂质量:①=②=③=④=⑤11. 能证明硝酸钾在20℃时已达到饱和状态的是( )A、取少量该溶液,升温后没有硝酸钾晶体析出 B、温度不变,向该溶液中加入少量水,溶质的质量分数变小 C、温度不变,向该溶液加入少量硝酸钾晶体,溶质质量分数不变 D、取少量该溶液,降温到10℃,有硝酸钾晶体析出12. 大地震后,为防止疾病传染,需对灾区喷洒消毒剂,进行医疗卫生防疫。质量分数为0.2%~1%的过氧乙酸就是用于环境喷洒和用具浸泡的一种消毒剂。现有市售质量分数为20%的过氧乙酸,要配制1%的过氧乙酸10kg,需要市售过氧乙酸的质量为( )A、1000g B、500g C、100g D、50g13. 有40g5%的硝酸钾溶液,若将其质量分数增大到10%,应采用的方法是 ( )A、把溶剂蒸发掉一半 B、加入40g溶质质量分数为15%的硝酸钾溶液 C、把溶液倒掉20g D、加入2g硝酸钾固体14. 下列实验数据分析合理的是( )A、向H2O2溶液中加入5gMnO2 , 充分反应后MnO2的质量仍为5g B、将5g NaCl溶解在100g水中,得到溶液中NaCl的质量分数为5% C、 D、使5g Mg完全燃烧后,生成物的质量仍为5g15. 现有M、N两物质在室温下的饱和溶液,升温后,M溶液有晶体析出,而N溶液还可以再溶解N晶体,则能符合题意表示M、N两种物质溶解度曲线的是( )A、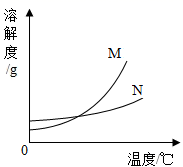 B、
B、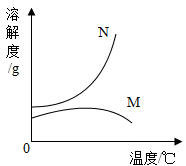 C、
C、 D、
D、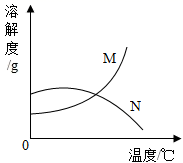
二、填空题
-
16. A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答:
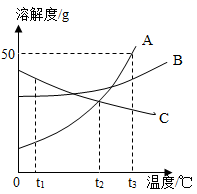
①t1℃时,A、B、C三种物质的溶解度由大到小的顺序是。
②当温度在t2~t3℃之间时,A物质与B物质(填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
③将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是。
④t3℃时将75gA的饱和溶液稀释成20%的溶液需加g水。
17. 氯化钠具有广泛的用途。(1)、生理盐水中的溶剂是。(2)、生理盐水标签如图所示。某同学欲将配制标签中所标示的生理盐水一瓶,需要水的质量是g。 (3)、氯化钠主要存在于海水中,海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4 等物质,如图是它们的溶解度曲线。分别将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数从大到小的关系是(填写字母序号)。
(3)、氯化钠主要存在于海水中,海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4 等物质,如图是它们的溶解度曲线。分别将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数从大到小的关系是(填写字母序号)。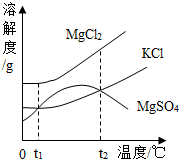 (4)、某同学利用实验探究NaCl在水中的溶解度,所得数据记录如下
(4)、某同学利用实验探究NaCl在水中的溶解度,所得数据记录如下序号
温度
水质量
加入NaCl质量
溶液质量
①
20℃
25g
9g
34g
②
20℃
50g
20g
68g
③
20℃
100g
34g
134g
④
20℃
150g
54g
204g
上述实验中,所得溶液为饱和溶液的是(填数字序号)。
三、综合题
-
18. NaCl、KNO3物质的溶解度曲线如图。

① a点表示。
② 60℃时,50g水中加入g硝酸钾恰好形成饱和
溶液,再往该溶液中加入115g水后,硝酸钾溶液的溶质
质量分数是。
③ 提纯混合溶液中的硝酸钾,进行如下实验。

操作II的名称为 , 溶液M中所含溶质为 。
④ 20℃时,将等质量的NaCl、KNO3固体分别加入到盛有100g水的烧杯中,充分搅拌后现象如
图1,加热到60℃时现象如图2(不考虑水分蒸发)。根据NaCl、KNO3物质的溶解度曲线回答:
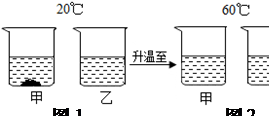
甲烧杯中加入的固体是(填“KNO3”或“NaCl”)。
对乙烧杯中溶液的分析,正确的是(选填编号)
Ⅰ.从20℃升温到60℃,溶质质量没有改变 Ⅱ.若对20℃溶液降温,一定会析出晶体
Ⅲ.20℃时,溶质与溶剂的质量比为31.6:100 Ⅳ.60℃时,溶液一定是不饱和溶液
四、实验探究题
-
19. 小刚同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如图所示。试回答下列问题:
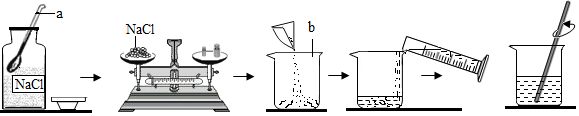 (1)、写出图中有标号仪器的名称:b。(2)、图示实验中玻璃棒的作用是。(3)、称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的质量(填“大于”或“小于”)配制溶液所需的质量。(4)、某同学在实验室用氯化钠固体和蒸馏水配制50g质量分数为6%的氯化钠溶液时,涉及以下实验步骤:①溶解,②称量和量取,③计算,④装入试剂瓶并贴好标签,配制该溶液正确的实验步骤顺序是(填序号),若配置该溶液的过程中,对量筒进行俯视读数,则测定结果将会(填“偏大”“不变”或“偏小”)。(5)、某注射药液的配制方法如下:
(1)、写出图中有标号仪器的名称:b。(2)、图示实验中玻璃棒的作用是。(3)、称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的质量(填“大于”或“小于”)配制溶液所需的质量。(4)、某同学在实验室用氯化钠固体和蒸馏水配制50g质量分数为6%的氯化钠溶液时,涉及以下实验步骤:①溶解,②称量和量取,③计算,④装入试剂瓶并贴好标签,配制该溶液正确的实验步骤顺序是(填序号),若配置该溶液的过程中,对量筒进行俯视读数,则测定结果将会(填“偏大”“不变”或“偏小”)。(5)、某注射药液的配制方法如下:①把1.0g药品溶于水配制成4.0mL溶液a;
②取0.4mL溶液a,加水稀释至1.0mL,得溶液b。
由于在配制过程中药液很稀,其密度都可近似看作1g·cm-3 , 则最终得到的药液(溶液b)中溶质的质量分数为。
20. 学习化学开启了我们认识物质之旅。某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。(1)、(探究一)溶解过程中的能量变化如下图所示,同学们设计了不同的实验方案进行探究:
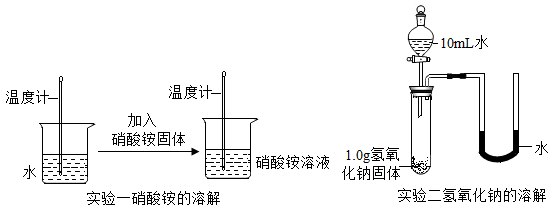
实验一中的硝酸铵溶解后,溶液温度(填“升高”、“降低”或“不变”)。
(2)、实验二所加试剂及用量如图,将分液漏斗中的水全部加入试管后,立即关闭分液漏斗的活塞,此时观察到U形管的液面左低右高,由此小明得出“氢氧化钠溶于水时放出热量”的结论,你是否同意小明的结论并写出你的理由。(3)、(探究二)氢氧化钠的化学性质如下图所示,同学们用氢氧化钠溶液进行了下列实验,请分析并回答下列问题:
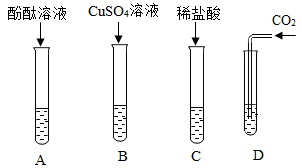
A试管中观察到的现象是。
(4)、B试管中发生反应的化学方程式:。(5)、C、D试管中均无明显现象。①为了证明D中已发生化学反应,向该试管中再加入足量的 , 观察到有气泡产生。
②为了证明氢氧化钠溶液和稀盐酸能发生化学反应,同学们设计并进行了如下实验:(所用稀盐酸经估算确保过量)
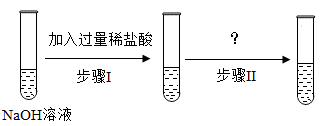
整个实验过程中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应。请写出步骤Ⅱ中所加试剂。
(6)、(探究三)氢氧化钠的应用实验室中的应用
实验室中能用氢氧化钠溶液吸收的气体是(填字母)。
a、二氧化碳
b、水蒸气
c、氯化氢
d、氧气
吸收上述所选气体,一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的不同。
(7)、工业中的应用氢氧化钠常用于制造人造丝、造纸、炼油、纺织、印染与橡胶工业。某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸4.9t(H2SO4的质量分数为20%),可以处理的废水质量是t。
结合化学方程式中的数据分析:若将等质量、等溶质质量分数的稀硫酸和氢氧化钠溶液混合,充分反应后,请判断溶液中一定含有的溶质,并简述你的判断理由:。
五、计算题
-
21. 某兴趣小组同学为了测定大理石中碳酸钙的质量分数,取一定量的大理石样品放入烧杯中,将60g稀盐酸分6次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下。
次数
1
2
3
4
5
6
加入稀盐酸质量/g
10
10
10
10
10
10
剩余固体质量/g
9.0
7.0
m
3.0
1.1
n
请根据以上信息回答下列问题:
(1)、m、n的值分别为、。(2)、该大理石样品中碳酸钙的质量分数为。(3)、计算所用稀盐酸溶质的质量分数。(写出计算过程,结果精确到0.1%)(4)、向上述反应后的滤液中滴加碳酸钠溶液,(已知氯化钙溶液呈中性)在溶液中插入pH传感器,测得pH变化曲线如图所示,下列有关说法正确的是 (填序号)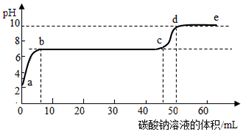 A、开始时溶液pH=2是因为滤液中还有盐酸 B、ab段表示随着Na2CO3溶液的滴入,CaCO3沉淀的质量逐渐增加 C、c点表示此时溶液呈中性 D、d点溶液中含有的溶质是NaCl和Na2CO3
A、开始时溶液pH=2是因为滤液中还有盐酸 B、ab段表示随着Na2CO3溶液的滴入,CaCO3沉淀的质量逐渐增加 C、c点表示此时溶液呈中性 D、d点溶液中含有的溶质是NaCl和Na2CO3
-