高中化学人教版(2019)必修第二册 第五章第三节 无机非金属材料
试卷更新日期:2021-02-26 类型:同步测试
一、单选题
-
1. 现代光学及光纤制品的基本原料是( )A、SiO2 B、Cu C、Al D、C2. 下列物质中属于酸性氧化物,但不能与水反应的是( )A、Na2O B、SiO2 C、CO D、SO23. 下列表述中正确的是( )
①提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料
④光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A、①②③ B、②④ C、①③⑤ D、③④⑤4. 2020年2月4日投入使用的武汉火神山医院在建设中使用了大量建筑材料。下列主要成分为无机非金属材料的是( )A、瓷砖 B、硫氧镁彩钢板
B、硫氧镁彩钢板  C、塑料管道
C、塑料管道  D、螺纹钢
D、螺纹钢  5. 某学生进行了如下实验:
5. 某学生进行了如下实验:编号
I
II
实验


现象
a中产生凝胶状沉淀
b中凝胶状沉淀溶解,c中无明显变化
下列结论正确的是( )
A、由I能说明酸性H2CO3> H2SiO3 B、由II可知结合氢离子的能力CO32- > HCO3- C、向Na2SiO3溶液中通入少量CO2 , 发生反应SiO32- +CO2+H2O=CO32-+H2SiO3↓ D、将新制的硅酸与硅酸钠溶液混合不会出现明显现象6. 下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )序号
X
Y
Z
W

①
Si
Na2SiO3
H2SiO3
SiO2
②
Na
NaOH
Na2CO3
NaCl
③
Cl2
Ca(ClO)2
HClO
HCl
④
Fe
FeCl3
FeCl2
Fe(OH)2
A、②③ B、①③④ C、①④ D、①②③7. 下列关于C、Si及其化合物结构与性质的论述错误的是( )A、键能 、 ,因此C2H6稳定性大于Si2H6 B、立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C、SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4 D、Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成 键8. 我国的瓷器以“入窑一色,出窑万彩"的神奇窑变而着称。下列关于陶瓷的说法正确的是( )A、瓷器中含有许多金属元素,因此陶瓷属于金属材料 B、高品质的白瓷晶莹剔透,属于纯净物 C、氮化硅陶瓷属于传统无机非金属材料 D、“窑变”是高温下釉料中某些金属化合物发生氧化还原反应导致的颜色变化9. 下列关于SiO2和Si的叙述中,正确的是( )A、都能跟强碱溶液反应,都不会跟任何酸反应 B、都能跟烧碱反应,都不会跟纯碱反应 C、Si能跟某些非金属单质反应,SiO2跟任何非金属单质都不反应 D、两者都是空间立体网状结构,熔点和沸点都比较高10. 清华大学的科学家将古老的养蚕技术与时兴的碳纳米管和石墨烯结合,发现通过给蚕宝宝喂食含有碳纳米管和石墨烯的桑叶,可以获得更加牢固的蚕丝纤维。已知:当把石墨片剥成单层之后,这种只有一个碳原子厚度的单层就是石墨烯。下列说法正确的是( )A、蚕丝纤维的主要成分是纤维素 B、石墨烯像烯烃一样,是一种有机物 C、碳纳米管和石墨烯互为同素异形体 D、碳纳米管具有丁达尔效应二、综合题
-
11. 现代化城市建设离不开各种材料。(1)、水泥具有性和强吸水性;水泥砂浆是、和水的混合物,是建筑用黏合剂;混凝土是、和的混合物,用钢筋做结构的混凝土强度很大。(2)、玻璃生产的主要原料是、和。12. 硅在地壳中的含量较高,硅及其化合物的开发由来已久。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
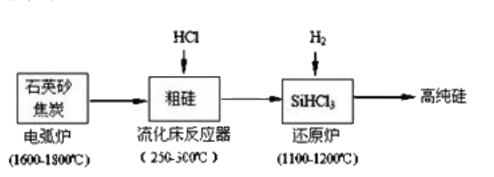 (1)、工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为。(2)、在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_。(3)、有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_;
(1)、工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为。(2)、在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_。(3)、有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_;SiHCl3极易水解且生成某种可燃性气体,其完全水解的产物为_。
物质
Si
SiCl4
SiHCl3
SiH2Cl2
SiH3Cl
HCl
SiH4
熔点/℃
1410
-70.4
-126.5
-122
-118
-114.2
-185
沸点/℃
2355
57.6
31.8
8.2
-30.4
-84.9
-111.9
(4)、还原炉中发生的化学反应为: 。.(5)、上述工艺生产中循环使用的物质除Si、SiHCl3外, 还有_。三、实验探究题
-
13.(1)、工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式。工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg + Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
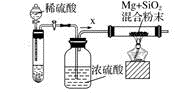 (2)、由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用(填序号)。
(2)、由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用(填序号)。a.石灰石
b.锌粒
c.纯碱
(3)、实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ;当反应引发后,移走酒精灯,反应能继续进行,其原因是。(4)、反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应① , ②。14. 在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。(1)、在空气中煅烧Ce(OH)CO3可制备CeO2 , 该反应的化学方程式;(2)、已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阴极的电极反应式;
(3)、某课题组用上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。
①过滤得到滤渣B时,需要将其表面杂质洗涤干净。洗涤沉淀的操作是。
②反应①的离子方程式为。
③如下图,氧化还原滴定法测定制得的Ce(OH)4产品纯度。

该产品中Ce(OH)4的质量分数为(保留两位有效数字)。若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度 (“偏高”、“偏低”或“无影响”)。