高中化学人教版(2019)必修第二册 第五章第一节 硫及其化合物
试卷更新日期:2021-02-26 类型:同步测试
一、单选题
-
1. SO2可用作红酒的防腐剂。下列关于SO2的叙述错误的是( )A、无色无味气体 B、能与氢氧化钠溶液反应 C、能使品红溶液褪色 D、一定条件下,能与氧气反应2. 下列反应中,浓硫酸表现出强氧化性的是 ( )
①用铁槽车盛装浓硫酸
②铜片与浓硫酸共热制备SO2
③浓硫酸与碘化钠固体共热
④浓硫酸吸收NH3
⑤浓硫酸使蔗糖炭化时有刺激性气体产生
⑥将含水蒸气的氯气通过盛浓硫酸的洗气瓶
⑦浓硫酸和乙醇共热制乙烯
⑧浓硫酸,乙醇和乙酸共热制乙酸乙酯
A、⑤⑥⑦⑧ B、①②⑤ C、①②③⑤ D、②③⑤3. 含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述错误的是( ) A、该过程中可得到化工产品H2SO4 B、该工艺流程是除去煤燃烧时产生的SO2 C、该过程中化合价发生改变的元素只有Fe和S D、图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO44. (NH4)2SO4在一定条件下发生如下反应: 4 (NH4)2SO4=N2↑+6 NH3↑+ 3SO2↑+ SO3↑+ 7H2O, .将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )A、生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3) 约为1: 1 B、生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 2 C、生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 3 D、从溶液中逸出的气体只有N2 , 最后留下溶液中溶质只有较多的NH4Cl5. 几种含硫物质的转化如图所示(部分产物可能略去)。下列说法错误的是( )
A、该过程中可得到化工产品H2SO4 B、该工艺流程是除去煤燃烧时产生的SO2 C、该过程中化合价发生改变的元素只有Fe和S D、图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO44. (NH4)2SO4在一定条件下发生如下反应: 4 (NH4)2SO4=N2↑+6 NH3↑+ 3SO2↑+ SO3↑+ 7H2O, .将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )A、生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3) 约为1: 1 B、生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 2 C、生成的沉淀中既有BaSO4、又有BaSO3 , 且n (BaSO4): n (BaSO3)约为1: 3 D、从溶液中逸出的气体只有N2 , 最后留下溶液中溶质只有较多的NH4Cl5. 几种含硫物质的转化如图所示(部分产物可能略去)。下列说法错误的是( )SO2 Na2SO3 溶液 Na2SO4溶液
A、X可以是Na2CO3溶液 B、Y一定是O2 C、反应①的离子方程式可能为:SO2+2OH- =SO + H2O D、SO2、Na2SO3都能使酸性高锰酸钾溶液褪色6. 某兴趣小组用如图所示的装置探究SO2气体的还原性,下列说法错误的是( ) A、①中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++ +4H+ B、①中加入KMnO4溶液,紫红色褪去,可说明SO2与FeCl3发生了氧化还原反应 C、②中蓝色溶液褪色的现象能表明I-的还原性弱于SO2 D、装置③的作用是吸收SO2尾气,防止污染空气7. 下列反应中,浓H2SO4既表现强氧化性又表现酸性的是( )A、2NaCl+H2SO4(浓) Na2SO4+2HCl↑ B、Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O C、S+2H2SO4(浓) 3SO2↑+2H2O D、Fe2O3+3H2SO4(浓)=Fe2(SO4)3+3H2O8. 白色固体Na2S2O4常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去。隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3 , 和SO2。下列关于Na2S2O4的说法不正确的是( )A、可以使品红溶液褪色 B、其溶液可以作吸氧剂 C、在空气中加热Na2S2O4固体可得到固体产物Na2SO4 D、Na2S2O4不能与强酸反应生成盐9. 下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是( )
A、①中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++ +4H+ B、①中加入KMnO4溶液,紫红色褪去,可说明SO2与FeCl3发生了氧化还原反应 C、②中蓝色溶液褪色的现象能表明I-的还原性弱于SO2 D、装置③的作用是吸收SO2尾气,防止污染空气7. 下列反应中,浓H2SO4既表现强氧化性又表现酸性的是( )A、2NaCl+H2SO4(浓) Na2SO4+2HCl↑ B、Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O C、S+2H2SO4(浓) 3SO2↑+2H2O D、Fe2O3+3H2SO4(浓)=Fe2(SO4)3+3H2O8. 白色固体Na2S2O4常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去。隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3 , 和SO2。下列关于Na2S2O4的说法不正确的是( )A、可以使品红溶液褪色 B、其溶液可以作吸氧剂 C、在空气中加热Na2S2O4固体可得到固体产物Na2SO4 D、Na2S2O4不能与强酸反应生成盐9. 下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是( )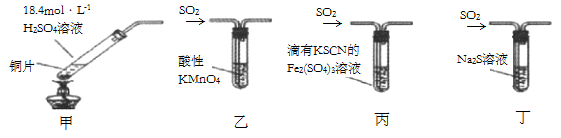 A、若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成 B、图乙装置中溶液的颜色变浅,说明SO2具有漂白性 C、图丙装置中溶液的颜色变浅,说明SO2具有还原性 D、图丁装置中产生淡黄色沉淀,说明SO2或H2SO4具有氧化性10. 0.1 mol Cu与足量浓硫酸加热,充分反应后,被还原的H2SO4的物质的量为(mol)( )A、<0.1 B、0.1 C、<0.2 D、0.211. 下列五种有色溶液与SO2作用,均能褪色,其实质相同的是 ( )
A、若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成 B、图乙装置中溶液的颜色变浅,说明SO2具有漂白性 C、图丙装置中溶液的颜色变浅,说明SO2具有还原性 D、图丁装置中产生淡黄色沉淀,说明SO2或H2SO4具有氧化性10. 0.1 mol Cu与足量浓硫酸加热,充分反应后,被还原的H2SO4的物质的量为(mol)( )A、<0.1 B、0.1 C、<0.2 D、0.211. 下列五种有色溶液与SO2作用,均能褪色,其实质相同的是 ( )①品红溶液 ②KMnO4酸性溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤淀粉碘溶液
A、①④ B、①②③ C、②③⑤ D、②③④12. 下列7种溶液中,通入足量的SO2气体,溶液变浑浊的有( )①Na2S溶液②Na2SiO3溶液③澄清石灰水④0.1mol/L Ca(ClO)2溶液⑤Ba(NO3)2溶液
⑥BaCl2溶液⑦酸性KMnO4溶液
A、3种 B、4种 C、5种 D、6种13. 某同学利用下图装置探究SO2的性质。
下列有关反应的方程式,错误的是( )
A、①中溶液显红色的原因: CO32-+ H2O HCO3-+ OH- B、①中溶液红色褪去的原因:2SO2 + CO32-+ H2O = CO2+ 2HSO3- C、②中溶液显黄绿色的原因:Cl2+ H2O = HCl + HClO D、②中溶液黄绿色褪去的原因:SO2+ Cl2 + 2H2O = H2SO4 + 2HCl14. 检验某溶液中是否含有 的方法是( )A、取样后加入BaCl2溶液,观察现象 B、取样后先加入BaCl2溶液,然后加入盐酸,观察现象 C、取样后加入硝酸酸化的BaCl2溶液,观察现象 D、取样后先用盐酸酸化,然后加入BaCl2溶液,观察现象二、实验探究题
-
15. 实验室里研究不同价态硫元素之间的转化
 (1)、A中发生反应的化学方程式为。(2)、B中的现象是。(3)、C中出现淡黄色沉淀,反应中Na2S做 (填“氧化剂”或“还原剂”)。(4)、D溴水褪色,该反应S元素的价态变化是由+4价变为价。(5)、某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,。(6)、E的作用是 , 离子方程式为。(7)、上述实验体现SO2 的性质有。16. 已知:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
(1)、A中发生反应的化学方程式为。(2)、B中的现象是。(3)、C中出现淡黄色沉淀,反应中Na2S做 (填“氧化剂”或“还原剂”)。(4)、D溴水褪色,该反应S元素的价态变化是由+4价变为价。(5)、某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,。(6)、E的作用是 , 离子方程式为。(7)、上述实验体现SO2 的性质有。16. 已知:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。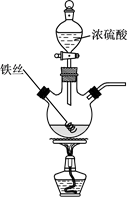 (1)、Ⅰ.溶液探究
(1)、Ⅰ.溶液探究将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+ , 可另取稀释液少许,滴加(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
(2)、为判断反应停止后硫酸是否有剩余,制定的实验方案为:测定稀释液的pH。请对此实验设计进行评价。。(3)、Ⅱ.气体探究将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由。
最后逸出的气体具有可燃性,推测该气体为H2 , 理由是(用离子方程式表示)。
(4)、收集混合气体336mL(已折算成标准状况),通入足量的氯水中,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl。滴加足量BaCl2溶液,生成的沉淀经过滤、洗涤、干燥、称量,测得质量为2.330g。则混合气体中SO2的体积分数为。(精确至小数点后第二位)(5)、将上述混合气体直接通入BaCl2溶液,未见明显现象,放置一段时间后发现有少许浑浊,分析其中的原因。17. 为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。 (1)、气体发生装置B产生的气体是。(2)、为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
(1)、气体发生装置B产生的气体是。(2)、为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:①氯化亚铁溶液 ②硫氰化钾溶液 ③品红溶液 ④酸性高锰酸钾溶液
a.若Cl2过量:取适量D中溶液滴加至盛有(选填一个序号)的试管内,再加入(选填一个序号)试剂,实验现象是。
b.若SO2过量:取适量D中溶液滴加至盛有(选填一个序号)的试管内,实验现象是。
(3)、另一小组设计如图所示的装置图(夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2 , 装置A中观察到的现象是否相同?(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,该反应的化学方程式为。
(4)、若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀生成,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:。三、综合题
-
18. 硫是人类认识最早的元素之一,含硫物质在现代生产和生活中发挥着重要作用。(1)、我国化学家姜雪峰因其在绿色有机硫化学领域的杰出贡献被遴选为“全球青年化学家元素周期表硫元素代表”。
①硫元素在元素周期表中的位置是 。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:。
(2)、自然界的硫循环过程如下图所示。
①上图所涉及的含硫物质中,能使品红溶液褪色的是。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做(填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3 , 该反应的化学方程式为。
19. 某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置已略去)。 (1)、试管①中反应的化学方程式是;(2)、若试管②中的试剂为品红溶液,实验中观察到的现象是;
(1)、试管①中反应的化学方程式是;(2)、若试管②中的试剂为品红溶液,实验中观察到的现象是;若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有性。
(3)、试管③中的试剂为NaOH溶液,其作用是 , 反应的离子方程式是。20. 硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某研究小组制备硫代硫酸钠晶体(Na2S2O3·5H2O)的实验装置如下图所示(省略夹持装置):
【查阅资料】
Ⅰ.Na2S2O3·5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;
Ⅱ.向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3。
根据题意,填写下列空白。
(1)、仪器a的名称是;B的作用是。(2)、C中反应氧化剂与还原剂的物质的量之比为。(3)、该实验制取的产品中常含有少量Na2SO3和Na2SO4杂质。为了检验产品中是否含有这两种杂质,某小组设计了以下实验方案(所需试剂从稀硝酸、稀硫酸、稀盐酸、蒸馏水中选择),请将方案补充完整。取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤后,向沉淀中滴加足量的(填试剂名称),若(填实验现象),则可以确定产品中含有Na2SO3和Na2SO4。
(4)、称取样品137.5 g配成500 mL溶液。取50 mL溶液,向其中加入足量稀硫酸,充分反应(S2O32-+2H+准确配制500 mL溶液所需仪器有:天平、药匙、烧杯、玻璃棒、、。经计算,样品中硫代硫酸晶体的百分含量为。(保留三位有效数字)
21. 黄铁矿主要成分是 FeS2。某硫酸厂在进行黄铁矿成分测定时,取 0.1000 g 样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为 0.02000 mol·L-1的 K2Cr2O7标准溶液滴定至终点,重复实验,平均消耗K2Cr2O7标准溶液 20.00mL。(1)、硫酸工业中煅烧黄铁矿的设备名称。(2)、该样品FeS2的质量分数为;