初中化学沪教版(上海)九年级下学期 第5单元测试卷
试卷更新日期:2021-02-26 类型:单元试卷
一、单选题
-
1. 下列实验操作正确的是( )A、熄灭酒精灯
 B、塞紧橡胶塞
B、塞紧橡胶塞  C、移走加热后的蒸发皿
C、移走加热后的蒸发皿 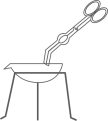 D、稀释浓硫酸
D、稀释浓硫酸 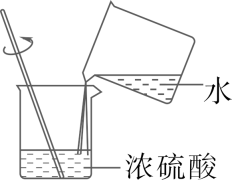 2. 下列饮品显碱性的是( )
2. 下列饮品显碱性的是( )饮品
柠檬汁
橘子汁
牛奶
豆浆
pH
2.2~3.5
3.1~4.2
6.3~6.6
7.4~7.9
A、柠檬汁 B、橘子汁 C、牛奶 D、豆浆3. 下列图示的实验操作正确的是( )A、闻气体气味 B、稀释浓硫酸
B、稀释浓硫酸  C、测溶液pH
C、测溶液pH 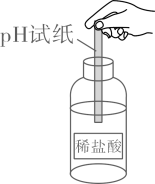 D、气密性检査
D、气密性检査 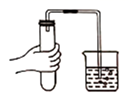 4. 20gKOH加入100g水中,配制成溶液。下列说法错误的是( )A、KOH在水中解离出K+和OH- B、一个K+带一个单位正电荷 C、该溶液的溶质质量分数为20% D、向该溶液中滴入酚酞指示剂,溶液变红5. 下列图示能正确反映对应变化关系的是( )
4. 20gKOH加入100g水中,配制成溶液。下列说法错误的是( )A、KOH在水中解离出K+和OH- B、一个K+带一个单位正电荷 C、该溶液的溶质质量分数为20% D、向该溶液中滴入酚酞指示剂,溶液变红5. 下列图示能正确反映对应变化关系的是( )①
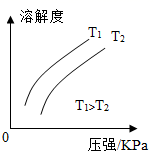 CH4的溶解度与温度、压强的关系
CH4的溶解度与温度、压强的关系②
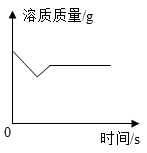 向Ca(OH)2饱和溶液中加少量CaO
向Ca(OH)2饱和溶液中加少量CaO③
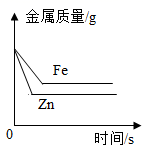 在等质量、等质量分数的两份稀硫酸中,分别加入过量的铁粉、锌粉(铁粉与锌粉质量相等)
在等质量、等质量分数的两份稀硫酸中,分别加入过量的铁粉、锌粉(铁粉与锌粉质量相等)④
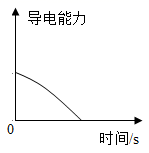 向稀硫酸中,逐滴加入与稀硫酸等质量、等质量分数的氢氧化钡溶液,测溶液的导电能力(离子浓度越大,溶液导电能力越强)A、②③ B、①② C、①④ D、③④6. 下列图象能正确表示对应叙述的有( )
向稀硫酸中,逐滴加入与稀硫酸等质量、等质量分数的氢氧化钡溶液,测溶液的导电能力(离子浓度越大,溶液导电能力越强)A、②③ B、①② C、①④ D、③④6. 下列图象能正确表示对应叙述的有( )
①向一定量硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液
②向一定量的饱和氢氧化钙溶液中加入氧化钙
③向等质量、等质量分数的稀盐酸中分别加入锌和铁
④向一定量的盐酸和硫酸钠的混合溶液中逐滴加入氢氧化钡溶液
A、1个 B、2个 C、3个 D、4个7. 若利用碱的性质进行下列实验,不能达到相应目的的是( )A、分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液 B、分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体 C、分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液 D、分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体8. 图像能直观体现化学中的各种变化关系,加深对化学知识的理解。下列图像不能正确反映对应关系的是( )A、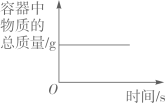 在密闭的容器中加热汞得到氧化汞
B、
在密闭的容器中加热汞得到氧化汞
B、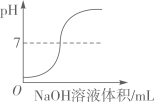 向一定量的稀盐酸中滴加氢氧化钠溶液
C、
向一定量的稀盐酸中滴加氢氧化钠溶液
C、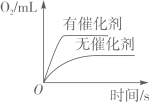 两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气
D、
两份等质量、等溶质的质量分数的过氧化氢溶液分别制取氧气
D、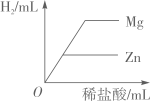 向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸
向等质量的Zn和Mg中分别滴加等溶质质量分数的稀盐酸
二、填空题
-
9. 生活与化学密切相关,生活中处处有化学,请你根据所学化学知识回答下列问题:(1)、生活中用生石灰(CaO)做干燥剂的理由是(用化学方程式表示)(2)、硫酸铜晶体(化学式为CuSO4.5H2O)可用作纺织品媒染剂、农业杀虫剂。硫酸铜晶体的摩尔质量是。25g硫酸铜晶体的物质的量是 , 含铜原子个。10. 综合复习时,同学们又来到化学实验室进行实验,加强对酸的化学性质的整体认识。他们将适量的稀盐酸分别滴加到六只试管中进行实验(如图所示),请回答下列问题:
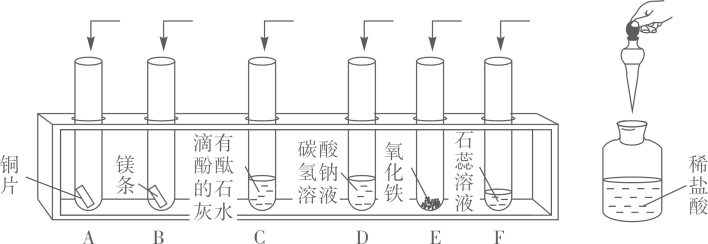 (1)、上述六只试管中有气泡产生的是(填序号),相关反应的化学方程式为(只写出一个)。(2)、能证明“C试管中发生了化学反应”的现象是。(3)、有一只试管中的物质不与稀盐酸反应,原因是。11. 学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)、上述六只试管中有气泡产生的是(填序号),相关反应的化学方程式为(只写出一个)。(2)、能证明“C试管中发生了化学反应”的现象是。(3)、有一只试管中的物质不与稀盐酸反应,原因是。11. 学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。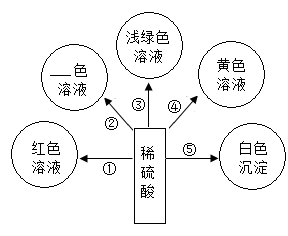 (1)、若用Cu(OH)2实现②,会得到色溶液。(2)、若想实现③,得到浅绿色溶液,可选用的单质是。(3)、若选用BaCl2溶液实现⑤,此反应的化学方程式为。12. 根据下图回答问题:
(1)、若用Cu(OH)2实现②,会得到色溶液。(2)、若想实现③,得到浅绿色溶液,可选用的单质是。(3)、若选用BaCl2溶液实现⑤,此反应的化学方程式为。12. 根据下图回答问题: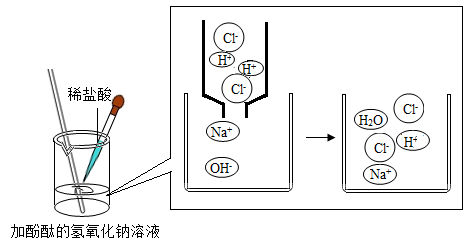 (1)、加入稀盐酸至过量能观察到的现象是。(2)、反应中,数目减少的离子是(填离子符号);(3)、验证反应后溶液中稀盐酸有剩余,下列操作可行的是。
(1)、加入稀盐酸至过量能观察到的现象是。(2)、反应中,数目减少的离子是(填离子符号);(3)、验证反应后溶液中稀盐酸有剩余,下列操作可行的是。A 取样,加入CuO粉末
B 取样,滴加NaOH溶液
C 取样,加入CaCO3粉末
D 取样,滴加AgNO3溶液
三、综合题
-
13. 酸碱盐在工农业生产和生活中应用广泛,请用所学化学知识回答问题。(1)、日常生活中有以下常见物质:白醋、纯碱、苛性钠、小苏打、硫酸铵,其中属于碱的是(填上述物质)。将少量无色酚酞溶液滴加到碱溶液中,溶液变。(2)、如饮食不当,胃会分泌出大量胃酸,服用含有下列哪种物质的药物可以中和过多胃酸,写出反应的化学方程式。
A、NaOH
B、Na2CO3
C、Al(OH)3
(3)、某氯化钠样品中,可能含有杂质:BaCl2、MgCl2、Na2SO4中的一种或几种,某校课外化学兴趣小组的同学进行实验探究杂质成分,探究过程如图(已知氢氧化镁难溶于水): 根据以上实验信息,用操作方法,可将上述实验过程中产生的白色沉淀与溶液分离,加入适量NaOH溶液的目的是 , 写出杂质与Na2SO4溶液反应的化学方程式。14. 镁及其合金是一种用途很广泛的金属材料。大量的镁是从海水蒸发结晶得到粗盐后的苦卤水中提取的。根据下列工业制镁的主要生产步骤回答问题:
根据以上实验信息,用操作方法,可将上述实验过程中产生的白色沉淀与溶液分离,加入适量NaOH溶液的目的是 , 写出杂质与Na2SO4溶液反应的化学方程式。14. 镁及其合金是一种用途很广泛的金属材料。大量的镁是从海水蒸发结晶得到粗盐后的苦卤水中提取的。根据下列工业制镁的主要生产步骤回答问题: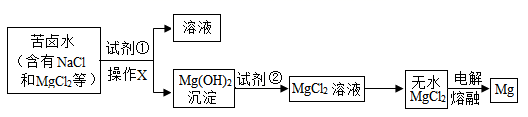 (1)、操作X的名称是。(2)、试剂②可选用。(3)、MgCl2在熔融状态下,通电后会产生金属镁和氯气(Cl2),该反应的化学方程式为。15. 某废酸液主要含H2SO4和FeSO4 , 研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如下:
(1)、操作X的名称是。(2)、试剂②可选用。(3)、MgCl2在熔融状态下,通电后会产生金属镁和氯气(Cl2),该反应的化学方程式为。15. 某废酸液主要含H2SO4和FeSO4 , 研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如下: (1)、该废酸液的pH7(填“<”或“>”)。操作Ⅰ的名称为。(2)、电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。(3)、“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是和(填化学式)。(4)、磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为。(5)、研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为。pH较低时产率较低的主要原因是。
(1)、该废酸液的pH7(填“<”或“>”)。操作Ⅰ的名称为。(2)、电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。(3)、“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是和(填化学式)。(4)、磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为。(5)、研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为。pH较低时产率较低的主要原因是。溶液的pH
6.0
6.5
7.0
7.5
8.0
9.0
产物颜色
黄褐色
黄褐色
较黑
很黑
很黑
灰黑色
产率(%)
43.9
50.6
86.2
93.0
92.3
91.6
16. A~F是初中化学常见物质。A是生命之源,是人体中含量最多的物质;B与A发生化合反应生成C,C俗称熟石灰;D是由三种非金属元素组成的盐,D和A混合,溶液温度显著降低,据此原理可制作“摇摇冰”;C与D混合加热反应生成A、E、F三种物质,E为有刺激性气味的气体。请回答下列问题:(1)、A的化学式为;电解A的实验,正、负极产生的气体体积比为。(2)、B俗称 , B与A反应的化学方程式为。(3)、C的澄清溶液通常用来检验气体。(4)、D在农业上可用作肥。(5)、E能使湿润的红色石蕊试纸变色。(6)、C与D混合加热反应的化学方程式为。四、实验探究题
-
17. 某化学兴趣小组同学为探究硫酸的化学性质,做了如下实验:
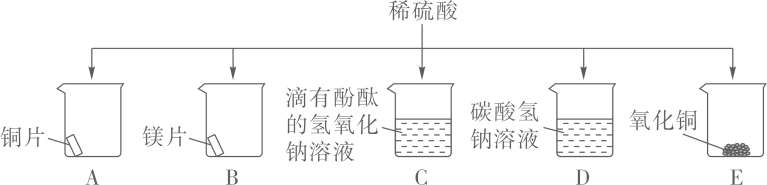 (1)、能产生气泡的是(填序号);(2)、溶液变为蓝色的是(填序号),写出其中发生的化学方程式。(3)、能证明C中发生了反应的现象是。(4)、实验过程中,发现只有A中无明显现象,说明铜与稀硫酸不发生反应。
(1)、能产生气泡的是(填序号);(2)、溶液变为蓝色的是(填序号),写出其中发生的化学方程式。(3)、能证明C中发生了反应的现象是。(4)、实验过程中,发现只有A中无明显现象,说明铜与稀硫酸不发生反应。(提出问题)铜与硫酸真的不能反应吗?
(查阅资料)
①铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
②SO2能使品红溶液褪色;
③SO2能与碱溶液反应;
④SO2能溶于水,但不溶于饱和NaHSO3溶液
(进行实验)
同学们在老师的帮助下用如图所示装置进行实验:

请回答下列问题:
实验开始时,打开开关K,发现D中品红溶液褪色,装置D中试管口放置的棉花上浸有浓氢氧化钠溶液,其作用是。
(5)、装置B的作用是收集贮存多余的气体,当D中有明显现象后,关闭K,移去酒精灯,但由于余热的作用,A有仍有气体产生,此时B中现象是:长颈漏斗内液面(填“上升”或“下降”),则B中盛放的液体为(填序号)A、水
B、氢氧化钠溶液
C、饱和石灰水
D、饱和NaHSO3溶液
(知识拓展)化学反应的进行与物质的溶质质量分数,反应条件都有一定的关系。
18. 某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们进行了以下探究:(1)、(提出问题)氢氧化钠溶液是否变质?变质程度如何?(做出猜想)猜想一:氢氧化钠溶液未变质
猜想二:氢氧化钠溶液完全变质
猜想三:。
(2)、(设计实验)请完成实验报告实验步骤
实验现象
实验结论
①取少量溶液于试管中,加入 , 充分反应。
猜想二成立
②将步骤①试管中的物质过滤,向滤液中加入。
无明显现象
(3)、(反思拓展)①氢氧化钠溶液变质的原因(用化学方程式表示),氢氧化钠溶液应保存。
②分别取两份完全变质的氢氧化钠溶液样品于试管中,向其中一份加入盐酸有气泡产生,另一份加入氢氧化钙溶液有白色沉淀产生,然后将两支试管中所有物质一起倒入废液缸中,得到无色澄清溶液,所得溶液中溶质一定有。

五、计算题
-
19. 鸡蛋壳中的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的质量分数,小明同学取12.0g碎鸡蛋壳于烧杯中,逐滴加入稀盐酸至过量,测得反应时间与烧杯内剩余物质的总质量如图所示。(鸡蛋壳中其他成分不参与反应)请回答下列问题:
 (1)、反应完全时生成二氧化碳质量为g(2)、样品中碳酸钙的质量分数是多少?(计算结果精确到 0.1%)20. 某兴趣小组欲测定一瓶标签破损的稀硫酸的溶质质量分数。实验室有一瓶固体氢氧化钠,需要配制成10%的NaOH溶液才能使用。取20g稀硫酸样品于烧杯中,将10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)、反应完全时生成二氧化碳质量为g(2)、样品中碳酸钙的质量分数是多少?(计算结果精确到 0.1%)20. 某兴趣小组欲测定一瓶标签破损的稀硫酸的溶质质量分数。实验室有一瓶固体氢氧化钠,需要配制成10%的NaOH溶液才能使用。取20g稀硫酸样品于烧杯中,将10%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题: (1)、要把2g氢氧化钠配制成10%的氢氧化钠溶液,需要加水的质量是。(2)、a点溶液中的溶质是(填化学式)。(3)、当滴加NaOH溶液至c点时,溶液显(填“酸性”、“中性”或“碱性”)。(4)、计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
(1)、要把2g氢氧化钠配制成10%的氢氧化钠溶液,需要加水的质量是。(2)、a点溶液中的溶质是(填化学式)。(3)、当滴加NaOH溶液至c点时,溶液显(填“酸性”、“中性”或“碱性”)。(4)、计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)