初中化学鲁教版九年级下学期 第八单元测试卷
试卷更新日期:2021-02-26 类型:单元试卷
一、单选题
-
1. 我市地处沿海,海洋资源丰富,综合开发海洋资源前景十分广阔。你认为海水中含量最多的金属元素是( )A、铝 B、钠 C、钙 D、铁2. 打开汽水瓶盖有大量的气泡逸出,说法错误的是( )A、溶解度变小 B、溶质的质量变小 C、溶液浓度不变 D、还是饱和溶液3. 从海水中制备纯碱和金属镁的流程如图所示:

下列说法错误的是( )
A、流程Ⅰ中依次向粗盐水中加入过量氢氧化钠溶液、碳酸钠溶液和适量稀盐酸去除可溶性杂质 B、流程Ⅱ吸氨是使溶液呈碱性,有利于吸收二氧化碳 C、上述流程涉及到三种基本反应类型 D、流程Ⅳ、V是通过化学方法富集氯化镁4. 粗盐中常含有CaCl2、MgCl2和可溶性的硫酸盐等。除杂操作中为了保证反应完全,所加试剂都应适当过量。如图是粗盐提纯的简单流程。
X、Y、Z、W代表所加溶液,X、Y、Z、W分别是( )
A、BaCl2 Na2CO3 NaOH HCl B、Na2CO3 BaCl2 HCl NaOH C、Na2CO3 BaCl2 NaOH HCl D、NaOH Na2CO3 HCl BaCl25. 下列关于化学反应2X+Y=2Z的叙述,错误的是( )A、Z一定是化合物 B、若agX与bgY充分反应,生成Z的质量可能为(a+b)g C、若X和Y的相对分子质量分别为m和n,则Z的相对分子质量为(m+n) D、在反应中X、Y、Z三种物质的粒子数目比为2:1:26. 下列在酸性溶液或碱性溶液中都能大量共存的一组离子是( )A、Na+ Ba2+ Cl- NO3- B、Na+ NH4+ SO4 2- CO32- C、Al3+ Na+ NO3- HCO3- D、Cu2+ Ba2+ Cl- SO42-二、综合题
-
7. 近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法流程如下:
 (1)、上图从海水中最终得到“NaCl(产品)”的过程属于(填“物理变化”或“化学变化”)。(2)、上图中反应①、③、④中,属于化合反应的是(填序号)。(3)、反应③的化学方程式为。(4)、反应①中的反应物是氯化钠和水,该反应的化学方程式为。8. 烟台有漫长的海岸线,蕴藏着丰富的海洋资源。
(1)、上图从海水中最终得到“NaCl(产品)”的过程属于(填“物理变化”或“化学变化”)。(2)、上图中反应①、③、④中,属于化合反应的是(填序号)。(3)、反应③的化学方程式为。(4)、反应①中的反应物是氯化钠和水,该反应的化学方程式为。8. 烟台有漫长的海岸线,蕴藏着丰富的海洋资源。
 (1)、海水淡化。可以采用如图1所示的膜分离法淡化海水,水分子可以通过淡化膜(海水中体积较大的盐的离子和其他分子不能通过)进入左侧的淡水池,从而得到淡水。下列说法中正确的是________(填字母序号)。A、膜分离法的原理与滤纸过滤原理类似 B、膜分离法还可以浓缩海水中的盐类物质 C、膜分离法也是一种分离混合物的方法 D、该膜分离法的目的是除去海水中的不溶物(2)、粗盐提纯。除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,为得到较纯的氯化钠,进行如下的实验操怍①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液③加入过量的NaOH溶液; ④加入适量的盐酸调节溶液的pH等于7;⑤过滤;⑥蒸发。下列操作顺序正确的是(填字母序号),其中操作④加入适量的盐酸调节溶液的pH等于7的目的是。
(1)、海水淡化。可以采用如图1所示的膜分离法淡化海水,水分子可以通过淡化膜(海水中体积较大的盐的离子和其他分子不能通过)进入左侧的淡水池,从而得到淡水。下列说法中正确的是________(填字母序号)。A、膜分离法的原理与滤纸过滤原理类似 B、膜分离法还可以浓缩海水中的盐类物质 C、膜分离法也是一种分离混合物的方法 D、该膜分离法的目的是除去海水中的不溶物(2)、粗盐提纯。除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,为得到较纯的氯化钠,进行如下的实验操怍①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液③加入过量的NaOH溶液; ④加入适量的盐酸调节溶液的pH等于7;⑤过滤;⑥蒸发。下列操作顺序正确的是(填字母序号),其中操作④加入适量的盐酸调节溶液的pH等于7的目的是。A.①③②④⑤⑥
B.③②①④⑤⑥
C.③①②⑤④⑥
D.②③①⑤④⑥
(3)、海水资源综合利用的部分途径如图2。①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,使碳酸氢钠结晶析出,该反应的化学方程式是。
②写出步骤Ⅰ电解饱和NaCl溶液的化学方程式是。
③海水制镁。实际生产中,步骤Ⅲ常选用作为沉淀剂,从海水中提取MgCl2历经步骤Ⅱ、Ⅲ、Ⅳ三步转换的主要目的是。
9. 某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50 g 10%的氯化钠溶液。 (1)、实验一:下图是同学们做粗盐提纯实验的操作示意图。请回答下列问题:
(1)、实验一:下图是同学们做粗盐提纯实验的操作示意图。请回答下列问题:操作③中的错误是。
(2)、操作④的名称是。当观察到时,停止加热。(3)、实验二:用提纯得到的精盐配制了50 g 10%的氯化钠溶液。计算:所需氯化钠质量为g,所需蒸馏水的体积为mL(水的密度约为1g/mL)。
称量:分别在天平左右两盘放上纸片,调节平衡后,应先放(填写“砝码”或“药品”)。
量取:准确量取所需蒸馏水。
溶解:该操作中玻璃棒的作用是。
实验反思:经检测,溶质质量分数偏小,其原因可能有(填序号)。
①氯化钠固体仍然不纯 ②烧杯洗涤后内壁不干燥
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
(4)、若将上述质量分数为10%的氯化钠溶液,稀释成质量分数为4%的氯化钠溶液,需要用到的仪器有量筒、玻璃棒、。10. 海洋中蕴藏着丰富的化学资源,从海水中提取金属镁的主要步骤如下:资料:海滩贝壳的主要成分是CaCO3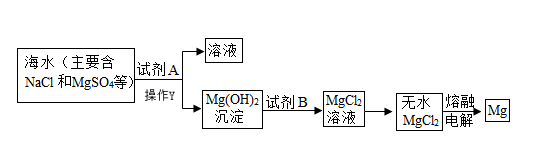 (1)、为节约资源,试剂A常用海滩贝壳为原料制得,则试剂X为(填化学式)。(2)、操作Y的名称为。(3)、在熔融状态下的MgCl2 , 通电后会生成镁与一种气体单质,该反应的化学方程式为;11. 如图1是甲、乙、丙三种固体的溶解度曲线,试回答:
(1)、为节约资源,试剂A常用海滩贝壳为原料制得,则试剂X为(填化学式)。(2)、操作Y的名称为。(3)、在熔融状态下的MgCl2 , 通电后会生成镁与一种气体单质,该反应的化学方程式为;11. 如图1是甲、乙、丙三种固体的溶解度曲线,试回答: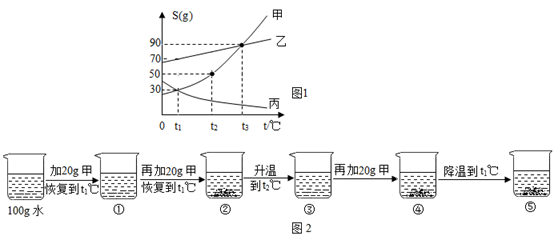 (1)、t2℃时,甲、乙、丙三种物质溶解度的由大到小的顺序是。(2)、乙溶液中含有少量甲的杂质,提纯乙晶体的方法是。(3)、某同学在t1℃时开始如图2所示实验,得到相应的溶液,下列说法错误的是。
(1)、t2℃时,甲、乙、丙三种物质溶解度的由大到小的顺序是。(2)、乙溶液中含有少量甲的杂质,提纯乙晶体的方法是。(3)、某同学在t1℃时开始如图2所示实验,得到相应的溶液,下列说法错误的是。A 在溶液①~⑤中,属于饱和溶液的是②④⑤
B 与溶液②溶质质量分数相等的是⑤
C 杯④中所得溶液的质量为160g
D 烧杯⑤中固体的质量为30g
(4)、t2℃时,要配制一瓶300g甲的饱和溶液,需要溶质甲的质量为 , 需要水的体积为。12. 西藏芒康县通过晾晒盐井水提取粗盐的生产方式历史悠久。粗盐溶液过滤后仍含有多种可溶性杂质(氯化镁、氯化钙、硫酸钠等)。某化学拓展实验小组欲探究粗盐样品中可溶性杂质的成分,设计了如图所示的实验流程: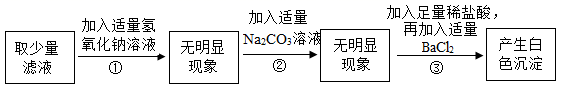 (1)、(实验分析)
(1)、(实验分析)步骤①中加入适量氢氧化钠溶液的目的是。
(2)、步骤③的白色沉淀是(填化学式)。(3)、乙同学认为步骤③中不需要加入足量稀盐酸,你是否同意他的观点?(填“同意”或“不同意”),请说明原因。(4)、根据以上实验信息,实验小组得出结论:此粗盐样品中含有的杂质是。三、推断题
-
13. A~F是初中化学常见的物质,它们的相互转化关系如图所示。已知A、B组成元素相同,E是天然气的主要成分,常温下B是液态物质。

请回答下列问题:
(1)、B的化学式是 , C的化学式是 ;(2)、请写出F的一种用途 ,(3)、写出反应①的化学方程式 , 其基本反应类型为。14. A、B、C、D、E是初中化学常见的物质,A是大理石的主要成分,D广泛用于玻璃、造纸、纺织和洗涤剂的生产,C转化为E的反应类型为化合反应。各物质之间的相互关系如图所示(“一”表示相邻的两种物质间能发生反应;“→”表示两种物质间的转化关系;部分反应物、生成物已略去)。请回答下列问题。 (1)、A的化学式为。(2)、C的用途为。(3)、D和E反应的化学方程式为。(4)、B→D发生的反应(填“属于”或“不属于”)复分解反应。15. 已知A、B为两种黑色粉末,A为单质,B为金属氧化物,D为红色单质。A、B、C、D、E五种物质之间的转化关系如下图所示。
(1)、A的化学式为。(2)、C的用途为。(3)、D和E反应的化学方程式为。(4)、B→D发生的反应(填“属于”或“不属于”)复分解反应。15. 已知A、B为两种黑色粉末,A为单质,B为金属氧化物,D为红色单质。A、B、C、D、E五种物质之间的转化关系如下图所示。
请回答:
(1)、B的化学式为;(2)、C的化学式为;(3)、反应①的化学方程式为;四、计算题
-
16. 实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将140g氯化钙溶液分四次加入,充分反应,
注:发生反应的化学方程式为
四次测量所得数据如表所示:
次数
累计加入氯化钙溶液的质量/g
烧杯中溶液的总质量/g
一
40
135
二
80
170
三
120
205
四
140
225
(1)、恰好完全反应时,生成沉淀的总质量为g。(2)、第四次测量时,所得溶液中的溶质有(填化学式)。(3)、计算氯化钙溶液的溶质质量分数(写出计算过程,计算结果保留到0.1%)17. 在盛有24.3g硫酸钠和氯化钠组成的固体混合物的烧杯中,加入100g水使硫酸钠和氯化钠全部溶解。向其中逐渐滴加溶质质量分数为20%的氯化钡溶液。生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图Z7-6所示,请根据题意回答问题。 (1)、过程中观察到的现象。(2)、滴加到B点时,溶液中的溶质是(填化学式)。(3)、当滴加氯化钡溶液至图中A点时,所得溶液中溶质的质量分数。(结果保留一位小数)
(1)、过程中观察到的现象。(2)、滴加到B点时,溶液中的溶质是(填化学式)。(3)、当滴加氯化钡溶液至图中A点时,所得溶液中溶质的质量分数。(结果保留一位小数)