初中化学鲁教版九年级下学期 第八单元第三节 海水“制碱”
试卷更新日期:2021-02-26 类型:同步测试
一、单选题
-
1. 下列有关盐的用途的说法错误的是( )A、氯化钠是重要的调味品 B、可用亚硝酸钠代替食盐腌渍食品 C、小苏打可用于培制糕点 D、碳酸钾可用作化学肥料2. 下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )A、NaCl B、NaOH C、NaHCO3 D、Na2SO43. 根据氨碱法生产纯碱的反应原理,下列有关理解中,错误的是( )A、用食盐制纯碱需要含碳、氧元素的物质 B、因为小苏打不溶于水沉淀析出,化学反应才能发生 C、某些物质的循环利用,既节约了资金,又保护了环境 D、氨气的使用促进了二氧化碳的反应,保证生产的顺利进行4. 下列关于实验现象的描述错误的是( )A、硝酸银溶液中加入碘化钾溶液,产生黄色沉淀 B、金属钠在氯气中燃烧,产生白烟 C、纯净的氢气在空气中燃烧,产生淡蓝色火焰,放出大量的热 D、光亮的铜丝伸入到稀硫酸中,溶液变为蓝色,同时产生大量气泡5. 下列各组离子在指定的溶液中能大量共存的是( )A、在稀盐酸中:Na+、Ba2+、 B、在氢氧化钠溶液中:H+、Mg2+、Cl- C、在氯化钾溶液中:Na+、Ca2+、 D、在氯化铵溶液中:K+、Cu2+、OH-
二、填空题
-
6. 选择相应物质的序号填空:
A.食盐 B.纯碱 C.硝酸钾 D.硫酸钾 E.聚乙烯 F.小苏打
(1)、属于复合肥。(2)、属于合成材料。(3)、常做调味品。(4)、是发酵粉的主要成分之一。7. 家庭或企业加工馒头、面包和饼干等食品时,常在面粉中加入膨松剂(如碳酸氢钠),蒸制或烘焙食品中产生大量气体,使面团疏松、多孔,制作的食品松软或酥脆,易于消化吸收。阅读上面信息后,回答: (1)、信息中提供的膨松剂是(填化学式);(2)、碳酸氢钠是一种性的化合物(填“可溶”或“不溶”);(3)、碳酸氢钠能使蒸制或烘焙的食品疏松多孔,原理是(用化学方程式解释)。8. 酸、碱、盐的溶解性表是学习化学的重要工具之一。下表是部分酸、碱、盐在水中的溶解性(20℃),请回答下列问题。
(1)、信息中提供的膨松剂是(填化学式);(2)、碳酸氢钠是一种性的化合物(填“可溶”或“不溶”);(3)、碳酸氢钠能使蒸制或烘焙的食品疏松多孔,原理是(用化学方程式解释)。8. 酸、碱、盐的溶解性表是学习化学的重要工具之一。下表是部分酸、碱、盐在水中的溶解性(20℃),请回答下列问题。阴离子
阳离子
OH-
NO3-
CO32-
Cl-
K+
溶
溶
溶
溶
Ba2+
溶
溶
不
溶
Cu2+
不
溶
不
溶
(1)、上述阴、阳离子形成不溶性碱的化学式为 , 形成复合肥料的化学式为。(2)、KOH溶液和Ba(NO3)2溶液(填“能“或“不能“)反应,理由是。(3)、下列各组离子在水溶液中能大量共存的是_______________ 。A、OH-、H+、Ba2+、NO B、OH-、Ba2+、K+、Cl- C、CO 、K+、Ba2+、Cl- D、CO 、Cu2+、NO 、K+三、实验探究题
-
9. 有一包白色粉末,含有硝酸钠、碳酸钠和硫酸钡,张南将这包白色粉末与稀盐酸(水足量)混合后,固体质量随时间变化关系如图所示。张南和小岗同学想对所得溶液溶质的成分进行实验探究,请你帮助两位同学完成如下实验及回答相关问题。
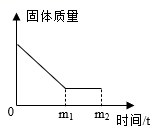
(提出问题)烧杯中溶液的溶质成分是什么?
(1)、(猜想与假设)张南同学猜想溶质成分是:NaNO3、NaCl、HCl
小岗同学猜想溶质成分是:NaNO3、NaCl、Na2CO3
你的猜想是;
张南猜想的理由是。
(2)、(实验验证)张南同学为了验证自己的猜想取少量滤液于试管中,向其中滴加少量硝酸银溶液观察到有白色沉淀的实验现象,于是得出结论:自己的猜想正确。请对张南同学由实验得出的的结论进行评价;
(3)、小岗同学取少量滤液于试管中,向其中滴加少量稀硫酸,观察到有气泡产生的实验现象,于是得出结论:同学的猜想正确。(4)、则由图像得出有关硫酸钡的性质有。(5)、(反思与总结)通过上述张南、小岗两位同学对溶液溶质成分的猜想,总结出猜想所得溶液中溶质成分时除需考虑可溶性的生成物和可溶性的反应物外,还需考虑的物质。
10. 学习复分解反应发生条件时,小红同学做了下表中的四个实验。试管编号
①
②
③
④
试管内试剂
NaOH溶液
MgCl2溶液
Na2CO3溶液
Ba(NO3)2溶液
加入硫酸后的现象
无明显现象
无明显现象
产生气泡
白色沉淀生成
(1)、根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为。(2)、小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是。(3)、为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。[提出猜想]猜想1:试管②中没有发生复分解反应,溶液中有MgCl2 , 即Mg2+和Cl-同时存在溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示SO42-会对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
[设计方案]

沉淀A的化学式是。
老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂改成。
小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是。
[实验反思]小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是。
11. 某同学在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液(如图甲所示),经实验员分析可知原瓶溶液中的溶质可能是NaCl、NaOH、Na2CO3、NaHCO3中的一种,为确认溶液中的溶质,他设计并进行了如下探究活动。(资料查阅)上述四种物质的相关信息如下:
物质
NaCl
NaOH
Na2CO3
NaHCO3
常温下的溶解度/g
36
109
21.5
9.6
常温下稀溶液的pH
7
13
11
9
请回答下列问题:
(实验探究1)

如上图乙所示,在操作①后可确定溶质不是NaCl,则实验现象应是;在进行操作②时有无色无味气体产生,由此又可排除的物质是。
(探究结论)分析四种物质的相关信息,你认为该溶液中的溶质可能是上述四种物质中的 , 你的判断依据是。若上述探究结论是正确的,操作②发生反应的化学方程式为。
(讨论质疑)有同学认为以上分析不严密,需要进一步实验确定,于是又进行了如下探究。
(实验探究2)向操作①后试管中的溶液中滴加过量CaCl2溶液(中性),充分反应后,试管中溶液颜色不变,又有白色沉淀产生。
(得出结论)通过实验探究2可确定原瓶溶液中的溶质应该是。
(反思拓展)造成该溶液出现上述实验现象的原因是(用化学方程式表示)。
四、综合题
-
12. 工业上用氨碱法制纯碱,制取过程如下:
 (1)、上图中①是。(2)、上述制取过程中的化学反应原理(用化学方程式)为。(3)、制取过程中先向饱和食盐水中通入较多的氨气,再通入足量的二氧化碳,其原因是:。(4)、但工业上不能用氨碱法制取碳酸钾,只是因为在溶液中。
(1)、上图中①是。(2)、上述制取过程中的化学反应原理(用化学方程式)为。(3)、制取过程中先向饱和食盐水中通入较多的氨气,再通入足量的二氧化碳,其原因是:。(4)、但工业上不能用氨碱法制取碳酸钾,只是因为在溶液中。a.KHCO3溶解度较大
b.KHCO3溶解度较小
c.K2CO3溶解度较大
d.K2CO3溶解度较小
13. 实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3•3H2O。其主要实验过程如图:
已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)、“酸溶”时发生反应的化学方程式为MgCO3+H2SO4=MgSO4+H2O+CO2↑和。(2)、“过滤Ⅱ”所得滤液中含有的主要离子有(填离子符号)。(3)、“反应”步骤前后均有过滤,能否省去“过滤Ⅰ”只进行“过滤Ⅱ”。(填“能”或“否”),理由是。(4)、“酸溶”时所加硫酸溶液不宜过量太多的原因是。14. 某未知溶液,可能含有Na+、Cu2+、Ba2+、SO42-、Cl-中的几种,为确定溶液中含有的离子,实验如下:①取未知溶液2~3mL于试管中,滴加足量BaCl2溶液,有白色沉淀生成,静置;②取①中上层清液,滴加AgNO3溶液,有白色沉淀生成;③另取未知溶液2~3mL于试管中,滴加NaOH溶液,有蓝色沉淀生成。分析实验过程,回答:(1)、溶液中一定存在的离子是。(2)、溶液中一定不存在的离子是。(3)、溶液中可能存在的离子是。15. 图中 是初中化学常见的物质。在通常情况下, 和 为气态, 通入无色酚酞溶液中,溶液变红;胃液中含适量的 ,可帮助消化; 与 发生中和反应。(图中“ ”表示两端的物质之间能发生化学反应,“ ”表示物质间存在转化关系,部分反应物和生成物已略去。)回答下列问题: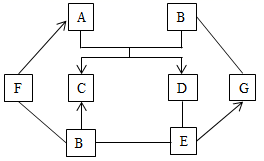 (1)、 的化学式为 。(2)、 反应的基本反应类型是 。(3)、 反应的化学方程式为 。(4)、图中属于化合反应的一个化学方程式为 。16. 已知A~G是初中化学常见的7种不同物质,其中D~G中都含有两种元素,C为蓝色沉淀。它们之间的转化关系如图所示(图中用“﹣”表示两种物质之间能发生化学反应,用“→”表示一种物质能转化为另一种物质,部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)、 的化学式为 。(2)、 反应的基本反应类型是 。(3)、 反应的化学方程式为 。(4)、图中属于化合反应的一个化学方程式为 。16. 已知A~G是初中化学常见的7种不同物质,其中D~G中都含有两种元素,C为蓝色沉淀。它们之间的转化关系如图所示(图中用“﹣”表示两种物质之间能发生化学反应,用“→”表示一种物质能转化为另一种物质,部分反应物、生成物及反应条件已略去)。请回答下列问题: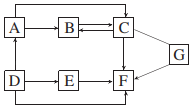 (1)、写出下列物质的化学式:A , D。(2)、写出G的一种用途:。(3)、A→B的基本反应类型是。(4)、写出E→F的化学方程式:。
(1)、写出下列物质的化学式:A , D。(2)、写出G的一种用途:。(3)、A→B的基本反应类型是。(4)、写出E→F的化学方程式:。五、计算题
-
17. 纯碱是一种重要的工业原料,盐湖中的纯碱常常会含有少量的氯化钠(其它杂质忽略不计)。取6g纯碱样品放在烧杯中并不断滴入稀盐酸,当稀盐酸滴加至35g时,烧杯内溶液的总质量为38.8g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。请计算:
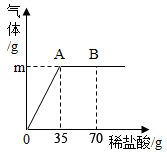 (1)、A点产生气体的质量m是g。(2)、B点时,烧杯内溶液中的溶质是(写化学式)。(3)、纯碱样品中碳酸钠的质量分数。(精确到0.1%)18. 某化工产品的成分是碳酸钙、氢氧化钙和硫酸钡,现取该化工产品样品20g放入锥形瓶内,向其中加适量水,振荡,然后再向锥形瓶中滴加溶质质量分数为10%的稀盐酸,反应生成二氧化碳的质量与加入稀盐酸的质量关系如图所示。
(1)、A点产生气体的质量m是g。(2)、B点时,烧杯内溶液中的溶质是(写化学式)。(3)、纯碱样品中碳酸钠的质量分数。(精确到0.1%)18. 某化工产品的成分是碳酸钙、氢氧化钙和硫酸钡,现取该化工产品样品20g放入锥形瓶内,向其中加适量水,振荡,然后再向锥形瓶中滴加溶质质量分数为10%的稀盐酸,反应生成二氧化碳的质量与加入稀盐酸的质量关系如图所示。
请回答下列问题:
(1)、该样品中钙元素的质量分数是(只填空,不列式计算)。(2)、计算该样品中氢氧化钙的质量。