初中化学鲁教版九年级下学期 第八单元第二节 海水“晒盐”
试卷更新日期:2021-02-26 类型:同步测试
一、单选题
-
1. 据《说文解字》记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是( )A、利用日晒,使海水分解 B、利用日晒,使氯化钠的溶解能力变小 C、利用阳光和风力,使海水中的水分蒸发 D、利用阳光和风力,使海水中的氯化钠蒸发2. 去除难溶性杂质后的食盐样品中还含有可溶性杂质:CaCl2、MgCl2和Na2SO4。为除去可溶性杂质,将食盐样品溶于水,依次加入稍过量的三种溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X,向滤液中加入过量的稀盐酸,搅拌、煮沸,得氯化钠溶液。下列说法正确的是( )
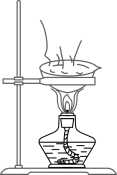 A、滤渣X中有三种成分 B、“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH C、除杂过程中有Na2CO3参加的化学反应为复分解反应 D、将氯化钠溶液用题35图装置加热蒸发,至水分完全蒸干时停止加热3. 小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是( )
A、滤渣X中有三种成分 B、“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH C、除杂过程中有Na2CO3参加的化学反应为复分解反应 D、将氯化钠溶液用题35图装置加热蒸发,至水分完全蒸干时停止加热3. 小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是( )温度/℃
0
10
20
40
60
80
100
溶解度/g
182
191
204
238
287
362
487
A、配制的蔗糖溶液下层比上层甜 B、降温,糖水中一定有晶体析出 C、20℃时,蔗糖饱和溶液质量一定为304g D、升温,糖水中蔗糖的质量分数不变4. 下列因素中,与固体物质的溶解度无关的是( )A、溶质的种类 B、溶剂的种类 C、温度的高低 D、溶质、溶剂量的多少5. 有关“不一定”的说法正确的是( )①冷却热饱和溶液,不一定有晶体析出
②在一定的条件下碳与氧气反应,不一定生成二氧化碳
③能使无色酚酞变红色的溶液,不一定是碱性溶液
④化合物中的某种元素转变为单质,不一定要通过分解反应
A、①②④ B、①②③ C、②③④ D、①②③④6. 如图是a、b两种固体物质的溶解度曲线。下列说法中错误的是( )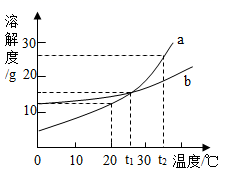 A、a、b两种物质都属于易溶性物质 B、t2℃时,将a、b的饱和溶液分别降温到t1℃时,析出的晶体的质量a比b多 C、t1℃时,a、b两种物质饱和溶液中溶质的质量分数相等 D、当a中含有少量b时,可以用降温结晶法提纯a7. 20℃时,将18.5g硝酸钠放入50g中,充分搅拌后全部溶解,则20℃时硝酸钠的溶解度为(单位g/100g水)( )A、37.0 B、18.5 C、9.25 D、无法计算8. 甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )
A、a、b两种物质都属于易溶性物质 B、t2℃时,将a、b的饱和溶液分别降温到t1℃时,析出的晶体的质量a比b多 C、t1℃时,a、b两种物质饱和溶液中溶质的质量分数相等 D、当a中含有少量b时,可以用降温结晶法提纯a7. 20℃时,将18.5g硝酸钠放入50g中,充分搅拌后全部溶解,则20℃时硝酸钠的溶解度为(单位g/100g水)( )A、37.0 B、18.5 C、9.25 D、无法计算8. 甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )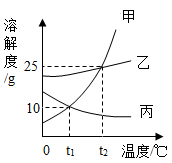 A、蒸发足量的溶剂一定可使丙的不饱和溶液变为饱和溶液 B、将t1℃,55g甲的饱和溶液升温至t2℃时刚好成饱和溶液 C、t1℃时,等质量的甲、乙、丙三种溶液所含溶质的质量大小顺序一定为乙>甲=丙 D、t2℃时,甲、乙、丙的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数大小顺序一定为乙>甲=丙
A、蒸发足量的溶剂一定可使丙的不饱和溶液变为饱和溶液 B、将t1℃,55g甲的饱和溶液升温至t2℃时刚好成饱和溶液 C、t1℃时,等质量的甲、乙、丙三种溶液所含溶质的质量大小顺序一定为乙>甲=丙 D、t2℃时,甲、乙、丙的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数大小顺序一定为乙>甲=丙二、填空题
-
9.(1)、人们日常的饮品很多,同学们多数喜欢碳酸饮料,碳酸饮料中溶解大量的二氧化碳,二氧化碳常温常压下在水中的溶解性是 (选“易溶”、“可溶”或“难溶”)。
当你打开汽水瓶盖时,会发现有大量气泡冒出,请解释出现这种现象的原因。
(2)、你喝了汽水之后往往会打嗝,请解释其中的缘由。10. 甲、乙两种固体物质在水中的溶解度曲线如图所示。据图作答: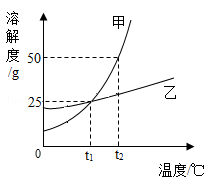 (1)、甲、乙两物质的溶解度受温度影响较大的是;在0℃~t1℃之间时,相同温度下甲物质的溶解度(填“>”“<”或“=”)乙物质的溶解度。(2)、t2℃时,把20g甲物质加入50g水中充分溶解,所得溶液为(填“饱和”或“不饱和”)溶液,把该溶液降温到t1℃时,会析出甲物质g。11. 生活在盐湖附近的人们习惯“冬天捞碱,夏天晒盐”。(1)、这里的“碱”是指碳酸钠,俗名为 , 这里的“盐”的主要成分为氯化钠。(2)、如图为碳酸钠和氯化钠的溶解度曲线,根据曲线回答问题:两条溶解度曲线中代表氯化钠的是(填“A”或“B”)。碳酸钠、氯化钠在温度为时溶解度相等,都等于g。
(1)、甲、乙两物质的溶解度受温度影响较大的是;在0℃~t1℃之间时,相同温度下甲物质的溶解度(填“>”“<”或“=”)乙物质的溶解度。(2)、t2℃时,把20g甲物质加入50g水中充分溶解,所得溶液为(填“饱和”或“不饱和”)溶液,把该溶液降温到t1℃时,会析出甲物质g。11. 生活在盐湖附近的人们习惯“冬天捞碱,夏天晒盐”。(1)、这里的“碱”是指碳酸钠,俗名为 , 这里的“盐”的主要成分为氯化钠。(2)、如图为碳酸钠和氯化钠的溶解度曲线,根据曲线回答问题:两条溶解度曲线中代表氯化钠的是(填“A”或“B”)。碳酸钠、氯化钠在温度为时溶解度相等,都等于g。 (3)、在t1℃,把20gA放入50g水中,用玻璃棒搅拌,完全溶解后所得溶液的溶质质量分数为(计算结果精确到0.1%),玻璃棒搅拌的目的是。(4)、将等质量的A、B饱和溶液从t1℃升温到t2℃,溶液中水(不考虑水的蒸发)的质量是AB(填“大于”、或“小于”或“相等”)。
(3)、在t1℃,把20gA放入50g水中,用玻璃棒搅拌,完全溶解后所得溶液的溶质质量分数为(计算结果精确到0.1%),玻璃棒搅拌的目的是。(4)、将等质量的A、B饱和溶液从t1℃升温到t2℃,溶液中水(不考虑水的蒸发)的质量是AB(填“大于”、或“小于”或“相等”)。三、综合题
-
12. 粗盐的主要成分是氯化钠,还含有可溶性杂质(氯化镁、氯化钙等)和不溶性杂质。小明同学想提纯粗盐并计算产率,他的操作步骤如下:(已知,常温下100克水中最多约溶解36克氯化钠)
 (1)、上述过程中除去的杂质是。(2)、操作Ⅰ的目的是:a;b.计算产率。(3)、操作Ⅴ是。(4)、操作Ⅳ中用到玻璃棒,其作用是;若得到的滤液浑浊,其原因可能是。(5)、已知:产率=精盐质量/粗盐质量。若计算得到的产率偏低,则可能的原因是:。13. 如图1是A、B、C三种物质的溶解度曲线图。请回答:
(1)、上述过程中除去的杂质是。(2)、操作Ⅰ的目的是:a;b.计算产率。(3)、操作Ⅴ是。(4)、操作Ⅳ中用到玻璃棒,其作用是;若得到的滤液浑浊,其原因可能是。(5)、已知:产率=精盐质量/粗盐质量。若计算得到的产率偏低,则可能的原因是:。13. 如图1是A、B、C三种物质的溶解度曲线图。请回答: (1)、t1℃时,A,B,C三种物质的饱和溶液中溶质质量分数最大的是。(2)、t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液的质量是。(3)、A物质中混有少量的B物质,若提纯A物质,可采用的结晶方法是。(4)、t1℃时,取等质量的A,C饱和溶液分别置于甲、乙两支试管中,如图2所示,在大烧杯中加入一定质量的氢氧化钠固体溶解后,A,C溶液的溶质质量分数的大小关系是。14. 难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)、t1℃时,A,B,C三种物质的饱和溶液中溶质质量分数最大的是。(2)、t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液的质量是。(3)、A物质中混有少量的B物质,若提纯A物质,可采用的结晶方法是。(4)、t1℃时,取等质量的A,C饱和溶液分别置于甲、乙两支试管中,如图2所示,在大烧杯中加入一定质量的氢氧化钠固体溶解后,A,C溶液的溶质质量分数的大小关系是。14. 难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下: (1)、在实验流程中加入过量的Ca(OH)2溶液,目的是除去主要成分中的;发生反应的化学方程式是。(2)、操作a的名称是。(3)、请写出固体B的两种主要成分、(用化学式表示)(4)、在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:
(1)、在实验流程中加入过量的Ca(OH)2溶液,目的是除去主要成分中的;发生反应的化学方程式是。(2)、操作a的名称是。(3)、请写出固体B的两种主要成分、(用化学式表示)(4)、在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:实验
温度/℃
Ca(OH)2用量/g
K+浸取率/%
a
25
2.5
72.4
b
40
2.5
86.55
c
40
3
90.02
d
60
3
91.98
e
60
4
91.45
①上述实验的数据中,温度与K+浸取率的关系是。
②上述5组实验中,若要获得最佳的K+浸取率,选择的反应条件是℃和Ca(OH)2g。