初中化学鲁教版九年级下学期 第七单元第四节 酸碱中和反应
试卷更新日期:2021-02-26 类型:同步测试
一、单选题
-
1. 如图两幅微观示意图揭示了化学变化的微观实质。相关说法中错误的是( )
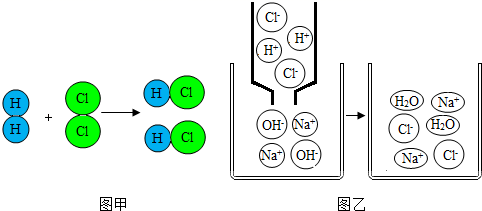 A、图乙说明中和反应的实质是H+和OH﹣反应生成了H2O B、图甲表示的是化合反应 C、图甲表示的反应中元素的化合价没有改变 D、上述两图说明化学反应前后原子的种类、数目都不会发生变化2. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、溶液是均一、稳定的,所以均一、稳定的物质一定是溶液 B、酸性溶液能使紫色石蕊变红,则使紫色石蕊变红的溶液一定呈酸性 C、中和反应有盐和水生成,所以生成盐和水的反应一定是中和反应 D、常温下,碱溶液的pH大于7,碳酸钠溶液的pH也大于7,则碳酸钠属于碱3. 做完实验后,对于用过的废酸,你认为正确的处理方法是( )A、拿出实验室 B、留在实验台上,准备下次实验用 C、放回原瓶 D、倒入废液缸中4. 如图,把质量与浓度都相同的盐酸与氢氧化钠溶液充分混合,则下列判断正确的是( )
A、图乙说明中和反应的实质是H+和OH﹣反应生成了H2O B、图甲表示的是化合反应 C、图甲表示的反应中元素的化合价没有改变 D、上述两图说明化学反应前后原子的种类、数目都不会发生变化2. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、溶液是均一、稳定的,所以均一、稳定的物质一定是溶液 B、酸性溶液能使紫色石蕊变红,则使紫色石蕊变红的溶液一定呈酸性 C、中和反应有盐和水生成,所以生成盐和水的反应一定是中和反应 D、常温下,碱溶液的pH大于7,碳酸钠溶液的pH也大于7,则碳酸钠属于碱3. 做完实验后,对于用过的废酸,你认为正确的处理方法是( )A、拿出实验室 B、留在实验台上,准备下次实验用 C、放回原瓶 D、倒入废液缸中4. 如图,把质量与浓度都相同的盐酸与氢氧化钠溶液充分混合,则下列判断正确的是( ) A、混合后溶液的pH=7 B、混合前后H2O的数目不变 C、混合后滴入紫色的石蕊溶液可变红 D、混合后得氯化钠溶液的溶质质量分数为16%5. 家庭中一些常见物质的pH如下表所示:
A、混合后溶液的pH=7 B、混合前后H2O的数目不变 C、混合后滴入紫色的石蕊溶液可变红 D、混合后得氯化钠溶液的溶质质量分数为16%5. 家庭中一些常见物质的pH如下表所示:物质
食醋
酱油
食盐水
牙膏
肥皂
pH
2~3
4~5
7
8~9
9~10
夏天我们被蚊虫叮咬后,蚊虫会在人的皮肤内分泌蚁酸(一种酸),从而使皮肤肿痛。要减轻痛痒,可在叮咬处涂抹下列物质中的( )
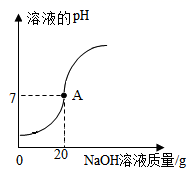
A、食醋 B、酱油 C、肥皂水 D、食盐水6. 河道两旁甲乙两厂,它们排放的工业废水中共含H+、Na+、Ba2+、Cl-、SO42-、CO32-六种离子。两厂废水中各含三种离子,其中甲厂的废水明显呈酸性,甲废水中的离子是( )A、H+、Na+、Ba2+ B、H+、Ba2+、Cl- C、Na+、SO42-、CO32- D、H+、SO42-、CO32-7. 某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )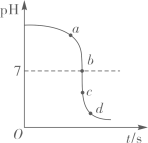 A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C、该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中 D、由c点到d点的变化过程中没有发生化学反应8. 我市有些滩涂地区的土壤被称为"盐碱地",当地农民常用引进内河淡水浸泡再排水的方法改良土壤。若以土壤pH为纵坐标,浸泡水次数(m)为横坐标,下列能正确表示土壤pH变化的图像的是( )A、
A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C、该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中 D、由c点到d点的变化过程中没有发生化学反应8. 我市有些滩涂地区的土壤被称为"盐碱地",当地农民常用引进内河淡水浸泡再排水的方法改良土壤。若以土壤pH为纵坐标,浸泡水次数(m)为横坐标,下列能正确表示土壤pH变化的图像的是( )A、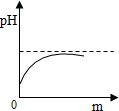 B、
B、 C、
C、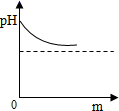 D、
D、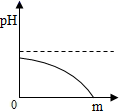
二、实验探究题
-
9. 某校化学兴趣小组的同学重点以“酸碱中和反应”为课题进行探究,小宇同学向烧杯中的氢氧化钠溶液中滴加稀硫酸,一会儿后发现忘了滴加酸碱指示剂,于是他停止滴加稀硫酸,同学们纷纷对实验后烧杯溶液中含有哪些溶质展开了讨论。(1)、(提出问题)实验的烧杯中溶质含有哪些物质?书写该反应的化学方程式。(2)、(提出猜想)猜想一:溶质中只有Na2SO4
猜想二:溶质中可能是Na2SO4和NaOH
猜想三:溶质中可能是。
(3)、(查阅资料)Na2SO4溶液呈中性。(实验探究)小宇同学设计如下的实验方案:
方法步骤
实验现象
实验结论
方案一
取少量烧杯中的溶液于洁净的试管中,滴入几滴无色酚酞溶液
酚酞不变红色
猜想一正确
猜想二不正确
方案二
取少量烧杯中的溶液于洁净的试管中,滴加BaCl2溶液
猜想三正确
方案三
取少量烧杯中的溶液于洁净的试管中,加入少量的黑色CuO粉末,振荡
猜想三正确
(4)、(方案评价)同学们对小宇上述的方讨论后认为:①方案一存在缺陷,该方案不能证明猜想一是正确的,其原因是。
②方案二也不能证明猜想三是正确的,理由是。
③同学们经过讨论,一致认为方案三能够证明猜想三是正确的,并认为还可以向烧杯的溶液中加入适量的(填字母序号)进行证明。
A Mg B Na2CO3 C NaOH D 紫色石蕊试液
(实验反思)在分析化学反应后所得物质成分时,还需考虑反应物的用量。
10. 中和反应是化学核心概念之一。某化学兴趣小组对中和反应展开了探究。(实验目的)证明氢氧化钠溶液与盐酸发生化学反应。
(实验步骤)
步骤一:取一定量稀氢氧化钠溶液于烧杯中,滴加2滴酚酞试液,溶液呈红色。
步骤二:用仪器A吸取稀盐酸向烧杯中逐滴加入,边滴加边用玻璃棒搅拌,红色变浅直至消失。
步骤三:向溶液中继续滴加稀盐酸至溶液呈酸性,用玻璃棒蘸取其中溶液,在酒精灯上加热至蒸干,有白色固体产生。
(1)、(思考拓展)从下列仪器中选择步骤二中的“仪器A”,名称是。
 (2)、兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。
(2)、兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。查阅资料:(i)酚酞试液在不同的pH时变化情况如下:
pH
0~8.2
8.2~10.0
10.0~14.0
颜色
无色
粉红色
红色
(ⅱ)氢氧化钠溶液的pH随浓度的降低而减小。
兴趣小组据此形成了对比实验方案以排除干扰,该对比实验方案是。
(3)、为确认步骤三中的白色固体是氯化钠而不是氢氧化钠,进行如下实验:步骤
现象
结论
将白色固体溶于水形成溶液,均分成两等份
向其中一份滴加CuSO4溶液,振荡、静置
①无色沉淀生成
白色固体不是NaOH。
向另一份滴加AgNO3溶液,振荡、静置
出现白色沉淀
②白色固体是NaCl,反应的化学方程式为。
(4)、(继续探究)如图1是氢氧化钠与盐酸反应的微观示意图。从微观角度分析,氢氧化钠溶液和盐酸反应的实质是。
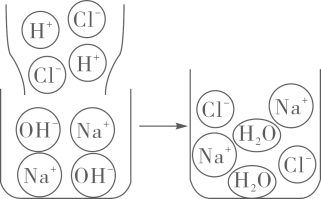 (5)、兴趣小组认为上述实验对反应实质缺少直观的验证。
(5)、兴趣小组认为上述实验对反应实质缺少直观的验证。査阅资料:(ⅲ)变色硅胶为蓝色,吸水后呈红色。(ⅳ)变色硅胶与NaOH固体充分混合,无明显现象;变色硅胶与无水醋酸(CH3COOH)充分混合,无明显现象。
兴趣小组据此设计了如图实验,验证中和反应有水生成:将无水醋酸迅速倒入装有NaOH固体和变色硅胶的试管中,并用玻璃棒在试管中不断搅拌,观察到变色硅胶由蓝色逐渐变为红色,U型管内液面左低右高。

①U型管内液面左低右高说明该反应热量(填写“放出”或“吸收”)。
②无水醋酸由CH3COO-和H+构成。变色硅胶由蓝色变成红色的原因是(用化学方程式表示)。
三、综合题
-
11. 某工厂的废水中含有MgSO4和FeCl3等,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
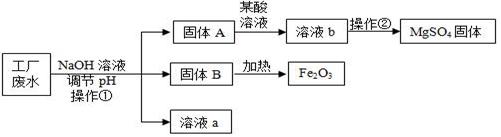
资料:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物
Fe(OH)3
Mg(OH)2
开始沉淀
1.9
9.1
完全沉淀
3.2
11.1
(1)、操作①的名称 , 该工厂废水一定呈性。(2)、用NaOH溶液调节溶液的pH,pH的控制在范围内,可使废液中的铁离子(Fe3+)完全沉淀,而镁离子(Mg2+)又不损耗。(3)、操作②时,当即可停止加热。(4)、固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为。(5)、溶液a除了可能含有NaOH外,还一定含有的溶质是(填化学式)。(6)、配制2000kg质量分数为5%的氢氧化钠溶液,需要氢氧化钠Kg。四、计算题
-
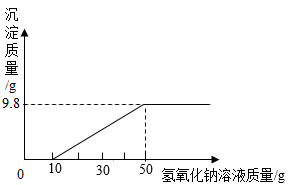
12. 用73g的稀盐酸和10%的氢氧化钠溶液进行反应实验时,反应过程中溶液的酸碱度变化如下图所示(反应的化学方程式 )。
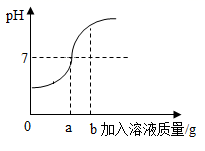 (1)、该实验是将(选填稀盐酸或氢氧化钠溶液)滴加到另一种溶液中。(2)、当加入溶液的质量为b时,此时溶液中的溶质是(填化学式)。(3)、当加入溶液的质量a为40g时,求所得溶液中溶质的质量分数。(结果精确到0.1%)
(1)、该实验是将(选填稀盐酸或氢氧化钠溶液)滴加到另一种溶液中。(2)、当加入溶液的质量为b时,此时溶液中的溶质是(填化学式)。(3)、当加入溶液的质量a为40g时,求所得溶液中溶质的质量分数。(结果精确到0.1%)
-