广东省韶关市乐昌市2020-2021学年九年级上学期化学期末考试试卷
试卷更新日期:2021-02-19 类型:期末考试
一、选择题(本大题包括15小题,每小题3分。共45分。每小题列出的四个选项中,只有一个选项符合题意)。
-
1. 物质的用途与其化学性质有关的是( )A、酒精作燃料 B、石墨作铅笔芯 C、铁水铸成锅 D、干冰用于人工降雨2. 决定元素种类的是( )A、核外电子数 B、中子 C、最外层电子数 D、质子数3. 2020年世界地球日的主题为“真爱美丽地球·守护自然资源”。下列做法与此不相符的是( )A、积极植树造林 B、尽量乘坐公交车出行 C、提倡使用农家肥 D、生活污水任意排放4. 空气是人类宝贵的自然资源。下列有关空气的说法错误的是( )A、食品包装袋里充满氮气防腐 B、氧气可用作火箭发射的燃料 C、空气的主要成分是氮气和氧气― D、二氧化碳是植物进行光合作用必需的物质5. 我国在1993年成功制取了一种由相对原子质量为18,核电荷数为8的氧原子构成的双原子氧分子,则下列说法正确的是( )A、这种气体的相对分子质量为32 B、这种氧原子与氢原子构成的水分子的相对分子质量为20 C、这种氧原子的核内质子数为10 D、这种氧原子的核外电子数为106. 如图所示的基本实验操作中错误的是(二氧化碳的密度比空气大)()A、
 倾倒液体
B、
倾倒液体
B、 检查气密性
C、
检查气密性
C、 收集二氧化碳气体
D、
收集二氧化碳气体
D、 滴加少量液体
7. 下列对一些事实的解释正确的是( )
滴加少量液体
7. 下列对一些事实的解释正确的是( )选项
事实
解释
A
加热氯酸钾时误将高锰酸钾加入后,反应速率加快了
高锰酸钾是该反应的催化剂
B
600升氧气被压缩在40升的钢瓶中
分子之间有一定间隔
C
变瘪的乒乓球放入热水中能鼓起来
分子大小随温度改变而改变
D
二氧化碳不支持燃烧
二氧化碳的密度比空气大
A、A B、B C、C D、D8. 我国科学家用滤纸和二氧化钛(TiO2)薄膜制出一种新型“纳米纸”,又在纳米纸上“铺”一层“萘胺”(C10H9N)染料,制成一种试纸,用于检测食品中亚硝酸盐浓度的高低。下列说法正确的是( )A、二氧化钛中Ti的化合价为+2价 B、萘胺中氮元素的质量分数约为11.9% C、这种试纸是一种新型化合物 D、萘胺中碳、氢、氮三种元素的质量比为120∶9∶ 149. 下列关于碳单质的说法正确的是( )A、C60的相对分子质量是720 B、石墨很软,不能用于制造石墨电极 C、石墨、金刚石和C60都是由碳元素组成,结构相同 D、木炭具有还原性,常温下可以将氧化铜中的铜还原出来10. 如图所示是某反应前后的微观示意图,“O”和“●”表示两种不同的原子。则该反应( ) A、是化合反应 B、有单质生成 C、反应前后分子种类不变 D、参加反应的两种分子个数比为4: 111. 类推是化学学习中常用的思维方法。下列类推结果正确的是( )A、CO、CH2OH5在氧气中燃烧都能生成CO2 , 则在氧气中充分燃烧能生成CO2的物质一定含有碳元素 B、单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 C、氧化物中一定含氧元素,则含有氧元素的物质一定是氧化物 D、硫在氧气中燃烧发出蓝紫色火焰,则铁在氧气中燃烧也一定能发出蓝紫色火焰12. 下列灭火方法不恰当的是( )。A、森林着火,可在火区周围伐木开辟隔离带 B、高层住宅着火,可用高压水龙头灭火 C、精密仪器着火,可用液态二氧化碳灭火器灭火 D、电器短路着火,可用泡沫灭火器灭火13. 某化学活动小组做了如下四个设想,你认为具有可行性的是( ) 。A、工业上可用“蒸馏法”淡化海水来解决我国的淡水危机 B、为了减少水体的污染,农业上禁止使用化肥和农药 C、当石油枯竭时,可用高梁、玉米和薯类来制造酒精代替汽油作为内燃机的燃料 D、工业上可制造大量的石灰水,来控制空气中二氧化碳的含量不断上升14. 通过下列实验操作和现象能得出相应结论的是( )
A、是化合反应 B、有单质生成 C、反应前后分子种类不变 D、参加反应的两种分子个数比为4: 111. 类推是化学学习中常用的思维方法。下列类推结果正确的是( )A、CO、CH2OH5在氧气中燃烧都能生成CO2 , 则在氧气中充分燃烧能生成CO2的物质一定含有碳元素 B、单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 C、氧化物中一定含氧元素,则含有氧元素的物质一定是氧化物 D、硫在氧气中燃烧发出蓝紫色火焰,则铁在氧气中燃烧也一定能发出蓝紫色火焰12. 下列灭火方法不恰当的是( )。A、森林着火,可在火区周围伐木开辟隔离带 B、高层住宅着火,可用高压水龙头灭火 C、精密仪器着火,可用液态二氧化碳灭火器灭火 D、电器短路着火,可用泡沫灭火器灭火13. 某化学活动小组做了如下四个设想,你认为具有可行性的是( ) 。A、工业上可用“蒸馏法”淡化海水来解决我国的淡水危机 B、为了减少水体的污染,农业上禁止使用化肥和农药 C、当石油枯竭时,可用高梁、玉米和薯类来制造酒精代替汽油作为内燃机的燃料 D、工业上可制造大量的石灰水,来控制空气中二氧化碳的含量不断上升14. 通过下列实验操作和现象能得出相应结论的是( )实验操作
现象.
结论
A
把带火星的木条插入某无色气体中
木条熄灭
该瓶中气体一定是二氧化碳
B
向收集满CO2的软塑料瓶中加入约三分之一体积的水,旋紧瓶盖,振荡
塑料瓶变瘪
CO2能溶于水
C
将白磷浸没在热水中,再向热水中的白磷通入氧气
通氧气前白磷不燃烧,通氧气后白磷燃
温度是燃烧需要的条件之一
D
点燃某气体,在火焰上方罩一个冷而干燥的烧杯
烧烧杯内壁有无色液滴产生
该气体是CH4
A、A B、B C、C D、D15. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( )。 A、丁一定是该反应的催化剂 B、该反应的基本类型是分解反应 C、参与反应的甲、乙质量比为14:3 D、参与反应的甲、丙质量比为7:10
A、丁一定是该反应的催化剂 B、该反应的基本类型是分解反应 C、参与反应的甲、乙质量比为14:3 D、参与反应的甲、丙质量比为7:10二、填空题(本大题包括2小题,共15分)
-
16. 下表为元素周期表的部分元素的相关信息,利用下表回答相关问题。
 (1)、最早提出现代元素周期律的俄国化学家是(2)、请画出16号元素原子结构示意图 , 化学反应中该原子比较容易(填“得到”或“失去”)电子变成离子;(3)、上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是(填化学式,任意填写一种);(4)、上表中第二、三周期元素最外层电子数的变化规律是17. 请沿用科学家认识事物的方式认识“空气”。(1)、从分类角度:空气属于(填“混合物”或“纯净物”)。(2)、从微观角度:用“○”表示氮原子,用“”表示氧原子。
(1)、最早提出现代元素周期律的俄国化学家是(2)、请画出16号元素原子结构示意图 , 化学反应中该原子比较容易(填“得到”或“失去”)电子变成离子;(3)、上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是(填化学式,任意填写一种);(4)、上表中第二、三周期元素最外层电子数的变化规律是17. 请沿用科学家认识事物的方式认识“空气”。(1)、从分类角度:空气属于(填“混合物”或“纯净物”)。(2)、从微观角度:用“○”表示氮原子,用“”表示氧原子。①用“
 ”可表示的微粒是(填名称)。
”可表示的微粒是(填名称)。②同温同压下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,下图中可表示空气微观模型的是(填字母标号)。
 (3)、从变化角度:已知:常压下,氮气沸点―196℃,氧气沸点--183℃。将燃着的木条置于盛满液态空气(模拟分离液态空气条件)的烧杯口,观察到的现象是。该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是(4)、从应用角度:利用空气制取氮肥的流程下图所示。
(3)、从变化角度:已知:常压下,氮气沸点―196℃,氧气沸点--183℃。将燃着的木条置于盛满液态空气(模拟分离液态空气条件)的烧杯口,观察到的现象是。该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是(4)、从应用角度:利用空气制取氮肥的流程下图所示。
①Ⅰ中参加反应的单质甲为
②Ⅱ中反应的化学方程式为
③物质所含元素化合价发生变化的反应称为氧化还原反应,反应Ⅱ(填“属于”或“不属于”)氧化还原反应。
(5)、从环保角度,下列保护空气措施不合理的有_____(填序号)。A、工厂通过加高烟囱直接排放废气 B、推广使用乙醇汽油代替普通汽油 C、提倡步行、骑自行车等“低碳”出行方式三、实验题(本大题包括2小题,化学方程式每个2分,除特别说明外,其他每空1分,共20分)
-
18. 图1所示为实验室中常见的气体制备和收集装置。

请回答下列问题:
(1)、实验室用加热氯酸钾和二氧化锰固体制取氧气,应选用发生装置(填字母序号),反应的化学方程式为。若用装置D收集氧气,验满的方法是(2)、实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C的优点是(3)、欲使用装置E用排空气法收集二氧化碳,则气体应从(填“a”或“b”)端通入;欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从(填“a”或“b”)端通入。(4)、已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置(填字母序号)。(5)、将二氧化碳气体通入紫色石蕊试液中,石蕊试液变红色,反应原理用化学方程式表示为(6)、如图2所示,向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳具有的化学性质是19. 某化学活动小组为探究碳与氧气反应的生成物,利用下列装置进行了如下实验(图中固定试管的仪器已略去)。回答:(1)、实验中发现,A中木炭粉明显减少,写出可能发生反应的化学方程式、(2)、B装置的作用是(3)、实验中观察到C装置中澄清石灰水变浑浊,D装置中黑色粉末变成红色粉末,写出D装置中发生反应的化学方程式;由上述现象可得出的结论是 (4)、此装置有明显的不足,应如何改进:
(4)、此装置有明显的不足,应如何改进:四、综合能力题(本大题包含1小题,共10分)
-
20. 已知A、B、C、D、E是初中化学中常见的五种物质。其中A、D是黑色固体,D具有磁性,B、C、E是无色气体,B的相对分子质量小于C,它们在一定条件下的转化关系如图所示(其他反应物和生成物己略去)。请回答下列问题:
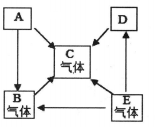 (1)、C是(填化学式)﹔(2)、写出E转化成D的化学方程式(3)、写出B在高温条件下还原D的化学方程式(4)、评述B物质的“利”与“弊”(各举一例)
(1)、C是(填化学式)﹔(2)、写出E转化成D的化学方程式(3)、写出B在高温条件下还原D的化学方程式(4)、评述B物质的“利”与“弊”(各举一例)五、计算题(本题包括1小题,共10分)
-
21. 乐昌市盛产石灰石,主要成分是CaCO3。某同学为了测定石灰石中碳酸钙的质量分数进行了如下实验。取一定量的石灰石样品研碎,与100g稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25 g。)
反应时间/s
0
20
40
60
80
100
烧杯和药品质量/g
140.0
137.8
135.6
m
134.5
134.5
请计算:
(1)、表中的“m”为g;(2)、该石灰石样品中碳酸钙的质量分数。(计算结果精确至0.1%)
-