浙江省嘉兴市经济开发区七校联考2020-2021学年九年级上学期科学期中阶段性质量调研试卷
试卷更新日期:2021-02-03 类型:期中考试
一、选择题(每小题3分,每小题只有一个正确答案,共45分)
-
1. 某校初中科学实验室所用的化学药品,很多是易燃、易爆、有毒、有腐蚀性的。在使用时,一定要严格遵照有关规定和操作规程,确保安全。现有下图所示四种图标,请你找出适合贴在存放氢氧化钠、氢氧化钾等浓碱药品橱上的图标( )A、
 B、
B、 C、
C、 D、
D、 2. 下列有关人体消化系统的描述中,正确的是( )A、所有的消化腺都能分泌消化液 B、身体缺乏维生素C,容易患夜盲症 C、食物中所含的营养成分,既是构成身体细胞的基本物质,又能提供能量 D、水、维生素、无机盐和麦芽糖可以不经消化被直接吸收3. 氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:①Co+2HCl=CoCl2+H2↑②CoCl2+2NaOH=Co(OH)2↓+2NaCl下列说法正确的是( )A、钴与金属铜的化学性质相同 B、氢氧化钴难溶于水 C、氢氧化钴的化学性质稳定 D、氢氧化钴可用于干燥氯化氢气体4. 如图为部分消化系统示意图,有关叙述正确的是( )
2. 下列有关人体消化系统的描述中,正确的是( )A、所有的消化腺都能分泌消化液 B、身体缺乏维生素C,容易患夜盲症 C、食物中所含的营养成分,既是构成身体细胞的基本物质,又能提供能量 D、水、维生素、无机盐和麦芽糖可以不经消化被直接吸收3. 氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:①Co+2HCl=CoCl2+H2↑②CoCl2+2NaOH=Co(OH)2↓+2NaCl下列说法正确的是( )A、钴与金属铜的化学性质相同 B、氢氧化钴难溶于水 C、氢氧化钴的化学性质稳定 D、氢氧化钴可用于干燥氯化氢气体4. 如图为部分消化系统示意图,有关叙述正确的是( ) A、①分泌的消化液只含有消化脂肪的酶,只能消化脂肪 B、②含有的消化液只能消化糖类 C、③分泌的消化液进入小肠,只能消化脂肪 D、④是消化与吸收的主要场所5. 如上图表示土壤的pH和植物吸收营养元素的关系。阴影部分纵向宽度越宽,表示植物对营养元素的吸收率越高。依据此图,下列说法正确的是( )。
A、①分泌的消化液只含有消化脂肪的酶,只能消化脂肪 B、②含有的消化液只能消化糖类 C、③分泌的消化液进入小肠,只能消化脂肪 D、④是消化与吸收的主要场所5. 如上图表示土壤的pH和植物吸收营养元素的关系。阴影部分纵向宽度越宽,表示植物对营养元素的吸收率越高。依据此图,下列说法正确的是( )。 A、土壤酸性越强,植物对三种元素的吸收率越高 B、土壤碱性越强,植物对磷元素的吸收率越高 C、土壤PH=8时,植物对三种元素吸收率最高的是钾 D、植物同时吸收三种元素的土壤PH最佳范围:5-66. 有一种“即食即热型快餐”适合外出旅行时使用,内层是用铝箔包裹并已加工好的真空包装食品,外层有分别包装的两包化学物质,使用时拉动预留在外的拉线,可使外层两包化学物质发生反应,此时便可对内层食品进行加热。这两包化学物质的最佳选择是( )A、浓硫酸和水 B、生石灰和水 C、石灰石和水 D、氯化钠和水7. 电影《黄金大劫案》上映后,里面用“王水”(浓盐酸与浓硝酸的混合液)溶解黄金的情景引起了广泛的热议。黄金溶解在“王水”中形成HAuCl4(四氯合金酸),没有氢气产生。根据以上信息,下列有关说法正确的是( )
A、土壤酸性越强,植物对三种元素的吸收率越高 B、土壤碱性越强,植物对磷元素的吸收率越高 C、土壤PH=8时,植物对三种元素吸收率最高的是钾 D、植物同时吸收三种元素的土壤PH最佳范围:5-66. 有一种“即食即热型快餐”适合外出旅行时使用,内层是用铝箔包裹并已加工好的真空包装食品,外层有分别包装的两包化学物质,使用时拉动预留在外的拉线,可使外层两包化学物质发生反应,此时便可对内层食品进行加热。这两包化学物质的最佳选择是( )A、浓硫酸和水 B、生石灰和水 C、石灰石和水 D、氯化钠和水7. 电影《黄金大劫案》上映后,里面用“王水”(浓盐酸与浓硝酸的混合液)溶解黄金的情景引起了广泛的热议。黄金溶解在“王水”中形成HAuCl4(四氯合金酸),没有氢气产生。根据以上信息,下列有关说法正确的是( )①“王水”溶解黄金是化学变化;②金比氢活泼;③HAuCl4中,Au的化合价为+3价;④可以将pH试纸伸入“王水”中测其酸碱度;⑤“王水”可以用铁质容器盛装。
A、①④⑤ B、①②③ C、③④⑤ D、①③8. 图甲是“观察小鱼尾鳍内的血液流动”实验图,图乙是在显微镜的低倍镜下观察到的血液流动图像,图中箭头表示血液流动的方向。下列说法正确的是( ) A、湿纱布的作用是维持鱼的体温 B、①是毛细血管 C、③是小静脉 D、实验结束后应将小鱼放入废物缸内9. 有关物质之间的部分转化关系如图所示.其中“﹣”表示物质之间能发生化学反应,“→”表示物质之间的转化关系.下列说法中正确的是( )
A、湿纱布的作用是维持鱼的体温 B、①是毛细血管 C、③是小静脉 D、实验结束后应将小鱼放入废物缸内9. 有关物质之间的部分转化关系如图所示.其中“﹣”表示物质之间能发生化学反应,“→”表示物质之间的转化关系.下列说法中正确的是( ) A、物质X是一种常见的有机化合物 B、反应②中一定有盐参加反应 C、向Ca(OH)2饱和溶液中加入CaO,温度会升高,所得溶液的溶质质量分数先增加后减小 D、图中的所有反应均不属于置换反应10. 要将待提纯的物质中杂质(括号内为杂质)除去,下表中选用的试剂及操作方法均正确的一是( )
A、物质X是一种常见的有机化合物 B、反应②中一定有盐参加反应 C、向Ca(OH)2饱和溶液中加入CaO,温度会升高,所得溶液的溶质质量分数先增加后减小 D、图中的所有反应均不属于置换反应10. 要将待提纯的物质中杂质(括号内为杂质)除去,下表中选用的试剂及操作方法均正确的一是( )选项
待提纯物质
选用试剂
操作方法
A
CuCl2(MgCl2)
镁片
过滤
B
CaO(CaCO3)
盐酸
蒸发
C
Cu(Fe)
稀硫酸
过滤
D
FeCl3溶液(盐酸)
氢氧化钠溶液
滴加
A、A B、B C、C D、D11. 根据事物的某些相似性类推其他的相似性,并预测类似的可能性,是我们经常使用的一种思维方法。①氧化物中都含有氧元素,含有氧元素的化合物都是氧化物;②饱和溶液不能继续溶解某种溶质,饱和溶液也不能继续溶解其他溶质;③氢氧化钠溶液中有OH- , 能与酸反应,氢氧化钾溶液中也有OH- , 也能与酸反应;④盐中含有金属离子和酸根离子,NH4NO3中没有金属离子,不属于盐类。以上类推结果与实际相符的是 ( )A、①②④ B、②③④ C、只有③ D、①②③④12. 有一包白色固体,可能含有Na2SO4、Na2CO3、 BaCl2、NaOH中的一种或几种。取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示。由此推断白色固体中( )。 A、可能存在Na2SO4 B、一定不存在NaOH C、肯定存在BaCl2 D、肯定只存在Na2CO313. 如图是关于氧气化学性质的部分知识网络,关于该图的说法正确的是( )
A、可能存在Na2SO4 B、一定不存在NaOH C、肯定存在BaCl2 D、肯定只存在Na2CO313. 如图是关于氧气化学性质的部分知识网络,关于该图的说法正确的是( ) A、Fe在Ⅰ、Ⅱ两类反应中的产物不相同 B、Ⅰ、Ⅱ两类反应均体现了氧气的可燃性 C、CO、CH4、C2H5OH均为有机物 D、Ⅰ类反应放出热量,Ⅱ类反应吸收热量14. 下列各组物质中,能相互反应且反应前后溶液总质量增加的是( )A、铁和硫酸铜溶液 B、氧化铁固体和稀硫酸 C、盐酸和澄清石灰水 D、氯化钠溶液和硝酸钾溶液15. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜实验,下列说法正确是( )
A、Fe在Ⅰ、Ⅱ两类反应中的产物不相同 B、Ⅰ、Ⅱ两类反应均体现了氧气的可燃性 C、CO、CH4、C2H5OH均为有机物 D、Ⅰ类反应放出热量,Ⅱ类反应吸收热量14. 下列各组物质中,能相互反应且反应前后溶液总质量增加的是( )A、铁和硫酸铜溶液 B、氧化铁固体和稀硫酸 C、盐酸和澄清石灰水 D、氯化钠溶液和硝酸钾溶液15. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜实验,下列说法正确是( )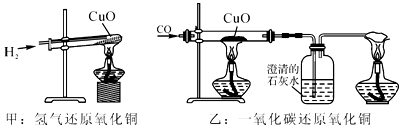 A、甲实验试管口向下倾斜可防止生成的水倒流,也有利于将试管内的空气完全排出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生置换反应
A、甲实验试管口向下倾斜可防止生成的水倒流,也有利于将试管内的空气完全排出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生置换反应二、简答题(每空2分,共40分)
-
16. 现有下列六种物质:①K2O;②CaO;③Na2O;④X;⑤Al2O3;⑥ZnO。它们是按某种规律排列的,请你推断X是 , 判断理由是。17. 我国在神木即将建成规模较大的甲醇(化学式为CH3OH)生产基地,请回答:(1)、甲醇属于(填“有机物”或“无机物”)。(2)、甲醇燃烧的化学方程式。18. 医院通常会对疑似糖尿病患者进行糖耐量测试,用以了解胰岛β细胞功能和机体对血糖的调节能力,进而诊断被测试者是否患有糖尿病。口服葡萄糖耐量试验,是指给人口服无水葡萄糖,然后测其血糖变化,观察病人耐受葡萄糖的能力,是目前公认的诊断糖尿病的标准。
 (1)、如图甲,若摄入的葡糖糖被吸收后,先到达心脏的(填图中字母)部位。(2)、图乙表示血液流经某器官或组织时,某物质含量的变化情况。下列有关表述,正确的是__ __。A、若该器官为小肠,曲线可表示二氧化碳或养料含量的变化 B、若该器官为肺,曲线可表示二氧化碳含量的变化 C、若该组织为骨骼肌,曲线可表示二氧化碳含量的变化19. "有一些花的颜色是红的、蓝的或紫的。这些花里含的色素叫‘花青素’,花青素遇到酸就变红,遇到碱就变蓝……"小勇阅读此段文字后,做了如下家庭实验:将一朵紫色喇叭花泡在肥皂水中,喇叭花很快变成了蓝色;将另一朵紫色喇叭花泡在厨房的某种调味品中,喇叭花变成了红色。请你根据以上实验现象 回答:(1)、小勇选用的调味品最有可能是 (填"食醋""酱油"或"纯碱");(2)、下列各组物质的溶液,仅用喇叭花不能鉴别的一组是 (填序号)。A、HCl、NaOH B、HCl、NaCl C、NaOH、NaCl D、H2O、NaCl20. 小明学习了金属活动性顺序后,欲进一步进行实验探究,他将一小块金属钠投入CuSO4溶液中,看到了下列现象:有大量气体产生,并出现了蓝色沉淀,但没有红色物质析出。小明通过查阅资料,发现钠能与水反应,于是又补做了另一个实验,并记录如下:
(1)、如图甲,若摄入的葡糖糖被吸收后,先到达心脏的(填图中字母)部位。(2)、图乙表示血液流经某器官或组织时,某物质含量的变化情况。下列有关表述,正确的是__ __。A、若该器官为小肠,曲线可表示二氧化碳或养料含量的变化 B、若该器官为肺,曲线可表示二氧化碳含量的变化 C、若该组织为骨骼肌,曲线可表示二氧化碳含量的变化19. "有一些花的颜色是红的、蓝的或紫的。这些花里含的色素叫‘花青素’,花青素遇到酸就变红,遇到碱就变蓝……"小勇阅读此段文字后,做了如下家庭实验:将一朵紫色喇叭花泡在肥皂水中,喇叭花很快变成了蓝色;将另一朵紫色喇叭花泡在厨房的某种调味品中,喇叭花变成了红色。请你根据以上实验现象 回答:(1)、小勇选用的调味品最有可能是 (填"食醋""酱油"或"纯碱");(2)、下列各组物质的溶液,仅用喇叭花不能鉴别的一组是 (填序号)。A、HCl、NaOH B、HCl、NaCl C、NaOH、NaCl D、H2O、NaCl20. 小明学习了金属活动性顺序后,欲进一步进行实验探究,他将一小块金属钠投入CuSO4溶液中,看到了下列现象:有大量气体产生,并出现了蓝色沉淀,但没有红色物质析出。小明通过查阅资料,发现钠能与水反应,于是又补做了另一个实验,并记录如下:操作步骤
实验现象
①将一小块钠放入盛水的烧杯中
金属钠在水面四处游动,并逐渐溶解有大量气体产生
②向反应后的溶液中滴加酚酞试液
溶液变红色
③将产生的气体收集并点燃
气体燃烧,并产生淡蓝色火焰
分析:由上述现象可知:金属钠与水反应后,生成物中呈碱性的物质是(选填“NaOH”或“Na2CO3”),其理由是
结论:据上述现象, Na投入CuSO4溶液中产生的蓝色沉淀是。
反思:按金属活动性顺序,一种活动性较强的金属(选填“能”、“不能”、“不一定能”)把另一种活动性较弱的金属从它的盐溶液中置换出来。
21. 如图是人体呼吸、消化、循环、泌尿系统的功能联系示意图,①~⑥表示生理过程或物质,请据图回答下列问题: (1)、①表示的气体是。(2)、图中③表示营养物质经消化系统吸收后进入循环系统,完成该过程的主要器官是。(3)、图中④和⑤表示的是物质交换的过程,该过程产生的废物主要通过(填序号)和皮肤排出体外。(4)、肾炎病人经治疗已恢复健康,他的尿液中不再含有大分子蛋白质和葡萄糖等物质,这是因为__________已恢复正常。A、肾小球的滤过作用 B、肾小管的重吸收作用 C、肾小球的滤过作用和肾小管的重吸收作用22. 物质王国举行一场趣味篮球赛。某队由铁、二氧化碳、硫酸、氢氧化钙、氯化铜五名“队员”组成,比赛中,由氯化铜“队员”发球,“队员”间传球(相互发生反应),最后由D位置“队员”投篮进球完成一次有效进攻。场上“队员”位置及传球路线如图所示。
(1)、①表示的气体是。(2)、图中③表示营养物质经消化系统吸收后进入循环系统,完成该过程的主要器官是。(3)、图中④和⑤表示的是物质交换的过程,该过程产生的废物主要通过(填序号)和皮肤排出体外。(4)、肾炎病人经治疗已恢复健康,他的尿液中不再含有大分子蛋白质和葡萄糖等物质,这是因为__________已恢复正常。A、肾小球的滤过作用 B、肾小管的重吸收作用 C、肾小球的滤过作用和肾小管的重吸收作用22. 物质王国举行一场趣味篮球赛。某队由铁、二氧化碳、硫酸、氢氧化钙、氯化铜五名“队员”组成,比赛中,由氯化铜“队员”发球,“队员”间传球(相互发生反应),最后由D位置“队员”投篮进球完成一次有效进攻。场上“队员”位置及传球路线如图所示。 (1)、已知D位置上投篮的“队员”是个灭火“能手”,则D位置“队员”代表的物质是;(2)、B位置“队员”所代表物质的一种用途是;(3)、写出连线④代表的物质间发生反应的化学方程式 , 连线①代表的物质间发生化学反应的基本类型是反应。
(1)、已知D位置上投篮的“队员”是个灭火“能手”,则D位置“队员”代表的物质是;(2)、B位置“队员”所代表物质的一种用途是;(3)、写出连线④代表的物质间发生反应的化学方程式 , 连线①代表的物质间发生化学反应的基本类型是反应。三、实验探究题(每空3分,共45分)
-
23. “潇湘”化学研究性学习小组对铁快速生锈进行了创新实验探究,实验设计如图。
实验操作如下:

①如图所示组装好仪器;
②用锥形瓶收集一瓶氧气,塞上胶塞。在烧杯中倒入少量滴有红墨水的水(水不要加太多,没过导管末端即可);
③打开胶塞,向锥形瓶中快速加入4mL饱和食盐水、2g铁系脱氧剂(主要成分是活性铁粉)。塞上胶塞,捏住乳胶管,轻轻摇晃锥形瓶,使悬浊液均匀挂在锥形瓶内壁上;
④将导管放入烧杯中,1分钟后,观察到导管中红色液柱高度超过25mm,锥形瓶内壁呈红褐色。
请回答下列问题:
(1)、实验步骤①组装好仪器后,立即需要进行的操作是 ;(2)、查资料得知,步骤④中红褐色固体为Fe(OH)3 , 它由生成的Fe(OH)2与氧气、水反应而来,写出生成红褐色固体的化学反应方程式;(3)、下列各项是同学们对该创新实验的判断与评价,你认为不太合理的是 _____。A、实验中用红墨水是便于观察 B、实验用氧气代替空气,毫无意义 C、实验用铁钉代替铁系脱氧剂,实验效果会更好 D、加入饱和食盐水可加快铁生锈的速度24. 在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。 (1)、方案一:测定稀H2SO4与NaOH溶液混合前后的pH值。将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH值 ,发现pH 小于7。
(1)、方案一:测定稀H2SO4与NaOH溶液混合前后的pH值。将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH值 ,发现pH 小于7。结论:稀H2SO4与NaOH溶液发生了化学反应,并且过量。
(2)、方案二:观察。(根据下图图示实验步骤,概括方案要点)结论:稀H2SO4与NaOH溶液发生了化学反应。
(3)、上述两个方案在设计思想上的相同点是。25. 现有一瓶久置的氢氧化钠溶液,根据所学知识回答下列问题: (1)、甲同学用实验方法证明了该瓶氢氧化钠溶液已变质.实验中取少量该溶液,加入了 , 观察到的现象是;(2)、乙同学用实验的方法除去因变质产生的碳酸钠,重新获得纯氢氧化钠溶液.
(1)、甲同学用实验方法证明了该瓶氢氧化钠溶液已变质.实验中取少量该溶液,加入了 , 观察到的现象是;(2)、乙同学用实验的方法除去因变质产生的碳酸钠,重新获得纯氢氧化钠溶液.①要除去Na2CO3 , 小明加入了下列试剂中的 ;
A、CuSO4溶液 B、澄清石灰水
C、BaCl2溶液 D、稀盐酸
②小明将反应后的杂质分离除去的实验操作是 .
(3)、丙同学想测定这瓶氢氧化钠溶液中碳酸钠的质量分数,实验装置如图,根据排出的饱和二氧化碳水溶液的体积可以计算出碳酸钠的质量。请画出B装置中的导管。26. 已知酶的催化作用要受到温度、酸碱度的影响。学习了酶的知识后,小柯同学想知道重金属离子是否对酶的催化作用也会产生影响,于是进行了如下探究:【资料】重金属一般指密度大于4.5g/cm3的金属。
【设计实验】取试管4支,编号,按表分别加入试剂,摇匀,迅速置于37℃的水浴中,10min后取出,冷却后分别加入碘液3滴,观察其颜色变化。
编号
0.25%淀粉溶液(mL)
蒸馏水(mL)
1%NaCl溶液(mL)
1%CuSO4溶液(mL)
唾液溶液(mL)
加入碘液3滴后现象
1
3
2
-
-
-
变蓝色
2
3
1
-
-
1
不变蓝
3
3
-
1
-
1
不变蓝
4
3
-
-
1
1
变蓝色
【实验结论】酶的催化作用要受到重金属离子的影响。
根据小柯同学的探究过程回答下列问题:
(1)、小柯同学提出猜想的依据是:酶是一种 , 遇到重金属离子会变性,从而丧失活性。(2)、比较上述实验中的1号和2号试管及观察到的现象,你可得出的结论。(3)、在看了小柯的设计及实验后,同桌小温认为凭上述实验还不足以证明小柯的猜想。小温提出应该将实验中的CuSO4溶液更换成CuCl2溶液才更有说服力。请你提出另一种改进方案:。(4)、根据以上所给信息,若有人误食波尔多液急性中毒,为解毒,下列四种供选物质中你可以选择的是。①鸡蛋清 ②鲜豆浆 ③鲜牛奶 ④糖水 ⑤食盐水
四、分析计算题:(27题6分,28题11分,29题13分,共30分)
-
27. 钢铁厂购进含氧化铁(Fe2O3)85%的赤铁矿石1000t,准备用CO还原这些铁矿石炼取含杂质3%的生铁,请利用化学方程式计算生铁的质量。(计算结果保留整数)28. 石灰石用途极为广泛.除了可以用于生产生石灰和水泥外,工业上还常常用沉淀法生产碳酸钙,具有很高的经济价值.我校科学探究小组同学对石灰石做纯度分析,进行了如下实验:
①用天平准确称取20克石灰石放入甲图A装置中,同时加入足量稀盐酸;
②测量C装置中吸收到的由反应过程中产生的二氧化碳的质量,并据此绘成乙图中的曲线;

③根据实验结果计算该石灰石的纯度.请分析回答下列问题:
(1)、甲图中装置B的作用是。(2)、忽略空气中二氧化碳及盐酸挥发对实验结果的影响,你认为由C装置测得的二氧化碳质量与反应产生的二氧化碳质量相等吗? , 试分析原因。(3)、根据实验数据计算该石灰石中CaCO3的质量分数。(写出计算过程)29. 某混合溶液由硫酸和硫酸铜溶液组成。上述小组同学又进行了如下实验:取124.5g该混合溶液于烧杯中,然后将120gNaOH溶液分六次加入其中,毎次充分反应后称量所得溶液的质量,所测数据如表所示。第1次
第2次
第3次
第4次
第5次
第6次
加入NaOH溶液的质量/g
20
20
20
20
20
20
反应后溶液的质量/g
144.5
164.5
179.6
189.8
200
220
每次产生沉淀的质量/g
0
0
m
n
9.8
0
计算:
(1)、上述表格中产生沉淀的质量:m= , n=。(2)、所加NaOH溶液中溶质的质量分数。(写出计算过程)(3)、第5次加入NaOH溶液充分反应后所得溶液中溶质的质量分数。(写出计算过程)