备考2021年高考化学二轮专题 第5讲 物质结构 元素周期律
试卷更新日期:2021-01-31 类型:二轮复习
一、单选题
-
1. 放射性同位素 I,其中数字“53”可以表示( )A、相对原子量 B、质量数 C、原子序数 D、中子数2. 下列化合物中既有共价键又有离子键的是( )A、Cl2 B、NaOH C、NaCl D、Na2O3. 下列关于化学用语的表示错误的是( )A、Na+的轨道表示式:
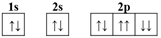 B、氯离子的结构示意图:
B、氯离子的结构示意图:  C、原子核内有8个中子的氧原子:
D、硫离子的核外电子排布式:1s22s22p63s23p6
4. 满足两个条件①离子化合物②不含有共价键的是( )A、N2H6Cl2 B、Ca(ClO)2 C、LiNH2 D、BaClBr5. X、Y、Z、W、G五种短周期主族元素,其原子序数依次增大。已知Y、W同主族,Y的最外层电子数是Z的6倍,X和Z的质子数之和等于G的质子数。下列说法正确的是( )A、化合物WY2能使溴水褪色表现为漂白性 B、G的简单阴离子比W的简单阴离子还原性强 C、X、Y、W三种元素气态氢化物的沸点依次升高 D、Z与W形成的化合物中可能含有共价键6. 下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的最高正化合价和最低负化合价代数和为0。下列说法错误的是( )
C、原子核内有8个中子的氧原子:
D、硫离子的核外电子排布式:1s22s22p63s23p6
4. 满足两个条件①离子化合物②不含有共价键的是( )A、N2H6Cl2 B、Ca(ClO)2 C、LiNH2 D、BaClBr5. X、Y、Z、W、G五种短周期主族元素,其原子序数依次增大。已知Y、W同主族,Y的最外层电子数是Z的6倍,X和Z的质子数之和等于G的质子数。下列说法正确的是( )A、化合物WY2能使溴水褪色表现为漂白性 B、G的简单阴离子比W的简单阴离子还原性强 C、X、Y、W三种元素气态氢化物的沸点依次升高 D、Z与W形成的化合物中可能含有共价键6. 下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的最高正化合价和最低负化合价代数和为0。下列说法错误的是( ) A、Z2X5可用来干燥剂NH3 B、T元素的单质具有半导体特性 C、X最低价氢化物比W最低价氢化物的稳定性强 D、可用CaCO3、Na2CO3和YX2在玻璃熔炉中制备玻璃7. 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是( )
A、Z2X5可用来干燥剂NH3 B、T元素的单质具有半导体特性 C、X最低价氢化物比W最低价氢化物的稳定性强 D、可用CaCO3、Na2CO3和YX2在玻璃熔炉中制备玻璃7. 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是( ) A、阴离子的还原性:Y>W B、W、Y、Z元素的简单离子半径由大到小顺序为Z>Y>W C、W2Y2中含有非极性键 D、Y与W形成的简单化合物是同主族元素同类型化合物中沸点最低的8. 短周期主族元素X、Y、Z、W原子序数依次增大,原子序数之和为42,X原子的核外电子数等于Y的最外层电子数,Z是第IA元素,W是同周期非金属性最强的元素。下列说法错误的是( )A、Y和W都存在可以用来消毒的单质 B、X、Y、Z和Y、Z、W都能组成在水中显碱性的盐 C、Y、Z能组成含有非极性键的化合物 D、W的氧化物的水化物的酸性一定比X的氧化物的水化物的酸性强9. 五种短周期元素在元素周期表中的位置如图所示,已知M原子最外层电子数是其电子层数的2倍,下列说法错误的是( )
A、阴离子的还原性:Y>W B、W、Y、Z元素的简单离子半径由大到小顺序为Z>Y>W C、W2Y2中含有非极性键 D、Y与W形成的简单化合物是同主族元素同类型化合物中沸点最低的8. 短周期主族元素X、Y、Z、W原子序数依次增大,原子序数之和为42,X原子的核外电子数等于Y的最外层电子数,Z是第IA元素,W是同周期非金属性最强的元素。下列说法错误的是( )A、Y和W都存在可以用来消毒的单质 B、X、Y、Z和Y、Z、W都能组成在水中显碱性的盐 C、Y、Z能组成含有非极性键的化合物 D、W的氧化物的水化物的酸性一定比X的氧化物的水化物的酸性强9. 五种短周期元素在元素周期表中的位置如图所示,已知M原子最外层电子数是其电子层数的2倍,下列说法错误的是( ) A、原子半径:Z>X>Y B、X和M 都能与Y形成两种常见的化合物 C、氢化物的稳定性:N<M D、工业上可以用X 单质与ZY2反应制得Z 单质10. 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
A、原子半径:Z>X>Y B、X和M 都能与Y形成两种常见的化合物 C、氢化物的稳定性:N<M D、工业上可以用X 单质与ZY2反应制得Z 单质10. 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( ) A、X、Y、Z三种元素中,X的非金属性最强 B、X单质的熔点比Z的低 C、Y的最高正化合价为+7价 D、Y的氢化物的稳定性比Z的氢化物弱
A、X、Y、Z三种元素中,X的非金属性最强 B、X单质的熔点比Z的低 C、Y的最高正化合价为+7价 D、Y的氢化物的稳定性比Z的氢化物弱二、综合题
-
11. 元素周期表是学习化学的重要工具,如图为元素周期表中部分元素的相关信息,利用如图回答相关问题。
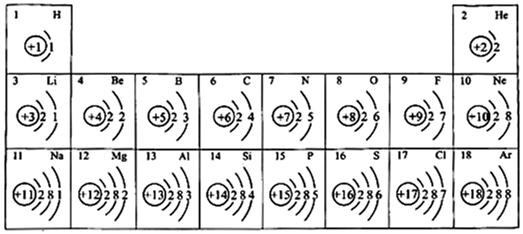 (1)、原子序数为4的元素符号为。(2)、C、N、O排在同一周期是因为(填“质子数”“电子层数”或“最外层电子数”)相同。(3)、He和Mg的化学性质(填“相似”或“不相似”)。(4)、画出Na+的结构示意图。(5)、一个磷原子含有个质子,一个NH 含有个电子。12.(1)、比较结合 H+能力的相对强弱:H2ONH3 (填“>”、“<”或“=”);用一个离子 方程式说明 H3O+和 NH4+给出 H+能力的相对强弱。(2)、NaOCN 是离子化合物,各原子均满足 8 电子稳定结构。写出 NaOCN 的电子式。(3)、乙酸汽化时,测定气体的相对分子质量,有数据表明其摩尔质量变为 120g·mol-1 , 从结构上 分析其可能的原因是13. 铁、钴均为第四周期Ⅷ族元素,它们的单质及化合物具有广泛用途. 回答下列问题:(1)、基态Co2+中成单电子数为;Fe和 Co的第三电离能I3(Fe)I3(Co) (填 “>”、“<”或“=”).(2)、化学上可用 EDTA 测定 Fe2+ 和 Co2+ 的含量. EDTA 的结构简式如图所示:
(1)、原子序数为4的元素符号为。(2)、C、N、O排在同一周期是因为(填“质子数”“电子层数”或“最外层电子数”)相同。(3)、He和Mg的化学性质(填“相似”或“不相似”)。(4)、画出Na+的结构示意图。(5)、一个磷原子含有个质子,一个NH 含有个电子。12.(1)、比较结合 H+能力的相对强弱:H2ONH3 (填“>”、“<”或“=”);用一个离子 方程式说明 H3O+和 NH4+给出 H+能力的相对强弱。(2)、NaOCN 是离子化合物,各原子均满足 8 电子稳定结构。写出 NaOCN 的电子式。(3)、乙酸汽化时,测定气体的相对分子质量,有数据表明其摩尔质量变为 120g·mol-1 , 从结构上 分析其可能的原因是13. 铁、钴均为第四周期Ⅷ族元素,它们的单质及化合物具有广泛用途. 回答下列问题:(1)、基态Co2+中成单电子数为;Fe和 Co的第三电离能I3(Fe)I3(Co) (填 “>”、“<”或“=”).(2)、化学上可用 EDTA 测定 Fe2+ 和 Co2+ 的含量. EDTA 的结构简式如图所示: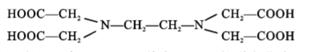
①EDTA 中电负性最大的元素是 , 其中 C原子轨道杂化类型为 ;
②EDTA 存在的化学键有 (填序号).
a. 离子键 b. 共价键 c. 氢键 d.σ键 e.π键 f. 配位键
(3)、将1mol CoCl3·4NH3溶于水中,加入足量 AgNO3溶液生成 1 mol AgCl沉淀. 则CoCl3·4NH3中配离子的化学式为;已知孤电子对与成键电子的排斥作用大于成键电子对与成键电子的排斥作用,试判断 NH3分子与钴离子形成配合物后 H-N-H 键角(填“变大”、“变小”或“不变”).(4)、一种铁氮化合物具有高磁导率,其结构如图所示: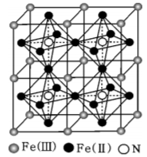
已知晶体的密度为ρg·cm-3 , 阿伏加德罗常数为 NA.
①该结构中单纯分析铁的堆积,其堆积方式为;
②该铁氮化合物的化学式为;
③计算 Fe(Ⅱ)构成正八面体的体积为cm3.
14. 短周期元素T、X、Y、Z的原子序数依次增大,其中元素T、X基态原子均有2个未成对电子,元素Y基态原子s能级的电子总数与p能级的电子总数相等,元素Z的价电子数等于电子层数。元素W位于第四周期,被誉为“太空金属”,其基态原子所含未成对电子数为2。(1)、①元素X、Y、Z的第一电离能由大到小的顺序为。(用元素符号表示)②元素W在周期表中的位置为 , 元素Y在周期表区。
(2)、T、X分别与氢组成的T2H2与H2X2分子中,T、X原子轨道的杂化类型分别是。(3)、T与X可形成TX 离子,TX 的空间构型为(用文字描述)。(4)、有同学推测,YX的熔点比氯化钠高,其原因是。(5)、下图为具有较高催化活性材料金红石的晶胞结构,其化学式为 , 判断其晶胞结构的最可靠科学方法是。已知该晶体的密度为ρ g·cm-3,W、X原子半径分别为a pm 和 b pm,阿伏加德罗常数的值为 NA , 则金红石晶体的空间利用率为(列出计算式)。 15.(1)、I.下列是中学化学中熟悉的物质,请用序号完成下列问题。
15.(1)、I.下列是中学化学中熟悉的物质,请用序号完成下列问题。①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2 ⑦氦气
这些物质中,只含共价键的是。只含离子键的是。既含共价键又含离子键的是。
(2)、属于离子化合物的是。(3)、II.20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是(填“吸热”或“放热”)反应,NO2和CO的总能量(填“大于”、“小于”或“等于”)CO2和NO的总能量。
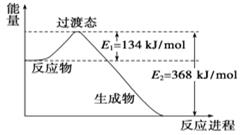 (4)、已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”)kJ的热量.16. 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
(4)、已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”)kJ的热量.16. 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题: (1)、MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外): , Mg在元素周期表中的位置: , Mg(OH)2的电子式:。(2)、A2B的化学式为。反应②的必备条件是。上图中可以循环使用的物质有。(3)、在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。
(1)、MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外): , Mg在元素周期表中的位置: , Mg(OH)2的电子式:。(2)、A2B的化学式为。反应②的必备条件是。上图中可以循环使用的物质有。(3)、在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。三、推断题
-
17. A、X,Y、Z、R、W为六种短周期元素。A是短周期中半径最小的元素;X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常作耐高温材料。回答下列问题:(1)、Y元素的名称是 , W在周期表中的位置是。(2)、写出化合物AZX的结构式:;化合物R2X2存在的化学键类型是。(3)、X、Z、R三种元素对应的简单离子半径由大到小大小:(用离子符号表示)。(4)、下列事实能证明非金属性强Z比Y的是(填序号)。
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)、写出工业上制备Z的单质的离子方程式: 。(6)、用电子式表示RZ的形成过程:。18. A、B、C、D、E、F为短周期元素,其中B的原子序数最小,它们的最高正价与原子半径关系如图所示.
回答下列问题:
(1)、B在元素周期表中的位置为.(2)、C与D可形成一种硬度很大的新型结构材料,其化学式为.(3)、同主族元素对应的单质或化合物在结构性质上体现相似性和递变性. 的电子式为;向 溶液中滴加稀盐酸,(填现象),发生反应的化学方程式为.(4)、元素周期表中某一元素的性质与它左上方或右下方的另一元素的性质相似,称为对角线规则,则A的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式为.(5)、D与F能形成一种三角锥形分子,该物质常温下是一种有刺激性气味的液体,与水反应能生成一种单质气体和两种酸,其中一种酸常用于杀菌、消毒,该物质与水反应的化学方程式为.