备考2021年高考化学二轮专题 第2讲 非金属元素及其化合物
试卷更新日期:2021-01-31 类型:二轮复习
一、单选题
-
1. 下列说法正确的是( )A、氯水具有杀菌、漂白作用是因为Cl2具有强氧化性 B、氯气能与碱反应,所以工业上用氯气和石灰水反应制备漂白粉 C、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- D、往饱和碳酸钠溶液中通入CO2气体,无明显现象2. 下列制取SO2、验证其漂白性、氧化性并进行尾气处理的装置和原理不能达到实验目的的是( )A、制取二氧化硫
 B、验证漂白性
B、验证漂白性  C、验证氧化性
C、验证氧化性  D、尾气处理
D、尾气处理  3. 实验室利用下图所示的装置制备干燥、纯净的氯气。下列有关叙述错误的是( )
3. 实验室利用下图所示的装置制备干燥、纯净的氯气。下列有关叙述错误的是( ) A、本实验操作顺序为:检验装置气密性→添加固体药品→添加液体药品→加热 B、装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液 C、氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气 D、装置Ⅴ中反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+ H2O4. 下列变化过程中不能直接实现的是( )
A、本实验操作顺序为:检验装置气密性→添加固体药品→添加液体药品→加热 B、装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液 C、氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气 D、装置Ⅴ中反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+ H2O4. 下列变化过程中不能直接实现的是( )①HCl ②Cl2 ③Ca(ClO)2 ④HClO ⑤CO2
A、④→⑤ B、①→② C、③→④ D、②→③5. 中学实验中,通常利用如图所示的装置进行喷泉实验,来验证HCl的极易溶于水。喷泉结束后,溶液占烧瓶体积的 ,下列有关说法错误的是( ) A、用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉 B、选用合适的溶液,CO2也能做喷泉实验 C、实验结果说明,原烧瓶内收集到的HCl气体占烧瓶总体积的 D、反应结束后,烧瓶中的盐酸溶液浓度为 mol/L6. 某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )
A、用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉 B、选用合适的溶液,CO2也能做喷泉实验 C、实验结果说明,原烧瓶内收集到的HCl气体占烧瓶总体积的 D、反应结束后,烧瓶中的盐酸溶液浓度为 mol/L6. 某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( ) A、该实验说明Cl2分子具有漂白性 B、该实验说明H+扩散速度比HClO分子快 C、将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色 D、若用久置的氯水进行实验,现象相同7. 有关下图海洋中部分资源的利用的说法错误的是( )
A、该实验说明Cl2分子具有漂白性 B、该实验说明H+扩散速度比HClO分子快 C、将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色 D、若用久置的氯水进行实验,现象相同7. 有关下图海洋中部分资源的利用的说法错误的是( ) A、工业上用Cl2与澄清石灰水反应制取漂白粉 B、用MgCl2·6H2O晶体制无水MgCl2 , 需在HCl气流中加热脱水 C、SO2水溶液吸收Br2的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr D、粗碘中混有少量ICl和IBr,可加入KI进行升华提纯8. 在标准状况下,将O2和NO按体积比3:4充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为( )A、 mol/L B、 mol/L C、 mol/L D、 mol/L9. 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
A、工业上用Cl2与澄清石灰水反应制取漂白粉 B、用MgCl2·6H2O晶体制无水MgCl2 , 需在HCl气流中加热脱水 C、SO2水溶液吸收Br2的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr D、粗碘中混有少量ICl和IBr,可加入KI进行升华提纯8. 在标准状况下,将O2和NO按体积比3:4充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为( )A、 mol/L B、 mol/L C、 mol/L D、 mol/L9. 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( ) A、洗气瓶中产生的沉淀是碳酸钡 B、在Z导管出来的气体中无二氧化碳 C、洗气瓶中产生的沉淀是亚硫酸钡 D、在Z导管口有红棕色气体出现10. 如图在A处通入 Cl2 , 当关闭B阀时,C处湿润的红色布条没有明显变化,当打开B阀时,C处湿润的红色布条逐渐褪色,则D瓶中所装的液体是( )
A、洗气瓶中产生的沉淀是碳酸钡 B、在Z导管出来的气体中无二氧化碳 C、洗气瓶中产生的沉淀是亚硫酸钡 D、在Z导管口有红棕色气体出现10. 如图在A处通入 Cl2 , 当关闭B阀时,C处湿润的红色布条没有明显变化,当打开B阀时,C处湿润的红色布条逐渐褪色,则D瓶中所装的液体是( ) A、水 B、浓硫酸 C、NaOH溶液 D、NaCl溶液11. 下列各项操作中,发生“先沉淀后溶解”现象的为( )
A、水 B、浓硫酸 C、NaOH溶液 D、NaCl溶液11. 下列各项操作中,发生“先沉淀后溶解”现象的为( )①向饱和Na2CO3溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴滴入过量的稀H2SO4
③向石灰水中通入CO2至过量
④CaCl2溶液中通入CO2至过量
A、①④ B、②③ C、①②④ D、③12. 浓硫酸分别和三种钠盐反应,下列分析正确的是( )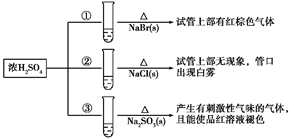 A、对比①和②可以说明还原性Br->Cl- B、①和③相比可说明氧化性Br2>SO2 C、②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl D、③中浓H2SO4被还原成SO2
A、对比①和②可以说明还原性Br->Cl- B、①和③相比可说明氧化性Br2>SO2 C、②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl D、③中浓H2SO4被还原成SO2二、实验探究题
-
13.(1)、I.化合物X由三种前四周期元素组成,按照如图流程进行实验。溶液C中只有一种溶质,白色沉淀D不溶于稀盐酸。请回答:

组成X的三种元素是(填元素符号),X的化学式是。
(2)、气体A通入酸化的KI溶液中,发生反应的离子方程式为。(3)、一定条件下X与水能反应,得到的混合液既有强氧化性又有强酸性。请写出其化学反应方程式:。(4)、Ⅱ.某兴趣小组为探究硝酸的性质,按如图进行实验:先打开弹簧夹,通入N2 , 一段时间后关闭弹簧夹,再打开分液漏斗的旋塞,使稀硝酸与铜片发生反应。实验中观察到装置②液面上方仍为无色气体,装置③液面上方气体由无色变为红棕色。请回答: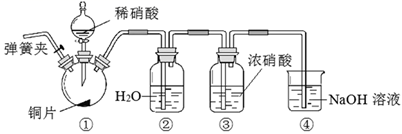
某同学认为虽然装置②液面上方的无色气体为NO,但不能说明装置①反应一定生成NO。理由是。
(5)、装置③液面上方气体由无色变为红棕色,其原因(用化学方程式表示)。14. 有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某小组在实验室对该反应进行探究,并对岩脑砂进行元素测定。[岩脑砂的制备]
 (1)、写出实验室装置A中发生反应的化学方程式:。(2)、装置C的仪器名称是;(3)、为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:→ef←(用小写字母和箭头表示,箭头方向与气流方向一致)。(4)、证明氨气和氯气反应有NH4Cl生成,需要的检验试剂中除了蒸馏水、稀硝酸、红色石蕊试纸外,还需要。(5)、[岩脑砂中元素的测定]
(1)、写出实验室装置A中发生反应的化学方程式:。(2)、装置C的仪器名称是;(3)、为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:→ef←(用小写字母和箭头表示,箭头方向与气流方向一致)。(4)、证明氨气和氯气反应有NH4Cl生成,需要的检验试剂中除了蒸馏水、稀硝酸、红色石蕊试纸外,还需要。(5)、[岩脑砂中元素的测定]准确称取a g岩脑砂,与足量氧化铜混合加热(反应:2NH4Cl+3CuO 3Cu+N2↑+2HCl+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。

装置H中盛装的试剂是(填试剂名称)。
(6)、若装置I增重b g,利用装置K测得气体体积为V L(已知常温常压下气体摩尔体积为24.5 L·mol-1),则岩脑砂中n(N):n(Cl)=(用含b、V的代数式表示,不必化简),若取消J装置(其它装置均正确),n(N):n(Cl)比正常值(填“偏高“偏低”或“无影响”)。15. “中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用。
已知有关信息:
①Si+3HCl SiHCl3+H2 , Si+2Cl2 SiCl4
②SiCl4遇水剧烈水解,SiCl4的熔点、沸点分别为-70.0 ℃、57.7 ℃。
请回答下列问题:
(1)、写出A中发生反应的离子方程式:。(2)、若拆去B装置,可能的后果是。(3)、有同学设计图装置替代上述E、G装置:
上图装置的主要缺点是。
(4)、测定产品纯度。取a g SiCl4产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用c mol·L-1标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液V mL。则产品的纯度为%(用含a、c和V的代数式表示)。(5)、某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。

①通过步骤Ⅰ知浓盐酸具有的性质是 (填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是 (填化学式)
③D中发生反应的化学方程式是:。
三、综合题
-
16. 碘在生活中有着广泛应用。一种由含碘废水制取单质碘的工艺流程如图:

回答下列问题:
(1)、检验含碘废水中是否含有I2 , 常用的试剂是。(2)、X是一种常见的有刺激性气味的气体,通入X气体的主要目的是。(3)、分离滤渣1各成分最简便的方法是;滤渣2在潮湿的空气中能被氧化为红褐色物质,故发生反应的化学方程式为。(4)、试剂Y是一种绿色氧化剂,其化学式为;操作I包括。17. 写出下列反应的离子方程式(已知还原性: ):(1)、向 溶液中通入少量 ( 与 的微粒数的比值 ):;(2)、向 溶液中通入足量 :;(3)、向 溶液中通入 , 与 的化学计量数之比为 :。18. 海水中溴含量约为65mg·L-1 , 从海水中提取溴的工艺流程如图: (1)、以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。(2)、步骤Ⅱ通入热空气吹出Br2 , 利用了溴的______(填字母)。A、氧化性 B、还原性 C、挥发性 D、腐蚀性(3)、步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
(1)、以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是 。(2)、步骤Ⅱ通入热空气吹出Br2 , 利用了溴的______(填字母)。A、氧化性 B、还原性 C、挥发性 D、腐蚀性(3)、步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:Br2+ = +Br-+CO2↑
(4)、上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式: 。(5)、实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是______(填字母)。A、稀硫酸 B、四氯化碳 C、烧碱溶液 D、水19. 从宏观现象探究微观本质是重要的化学学科素养。(1)、I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下: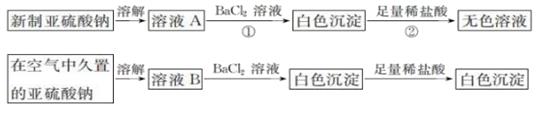
写出上述实验中②的离子方程式:。
(2)、通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有__(填化学式)。(3)、亚硫酸钠晶体样品若变质,下列说法错误的是 。A、晶体表面变黄 B、其水溶液pH将减小 C、其样品质量将增加(4)、II.以FeCl3 溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下: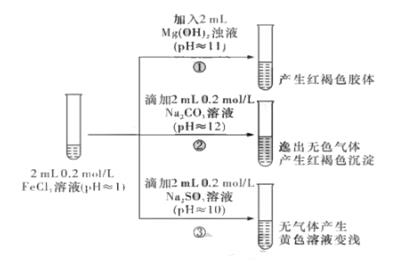
①中反应的离子方程式是._。
(5)、②中逸出的无色气体是_(写化学式)。(6)、对于③中的实验现象,同学们有诸多猜测,继续进行实验:甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液, 产生白色沉淀。得出结论:
FeCl3与Na2SO3 发生了氧化还原反应,离子方程式是_。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_。
20. 中学常见反应的化学方程式是A+B X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:(1)、若Y是黄绿色气体,则Y的电子式是 , 该反应的离子方程式是。(2)、若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .(3)、若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。①元素在周期表中的位置是(填所在周期和族);Y的化学式是。
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是mol。
(4)、若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是。21.(1)、I. 化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含 Na、Fe、N、O 四种元素。为研究安全气囊工作的化学原理,进行以下实验操作:
请回答下列问题:
工业上冶炼单质 2 的化学方程式为
(2)、若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为(3)、化合物甲可用下列方法制备:30℃时,将水合肼(N2H4•H2O)、亚硝酸甲酯(CH3ONO)、NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式
(4)、II. 晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl
已知①SiHCl3 沸点 33.0℃,上述反应在 1000~1100℃进行;
②SiHCl3 能与 H2O 强烈反应,在空气中易自燃。请回答下列问题:
下列说法不正确的是
A、装置B 中的溶液可以是浓硫酸 B、装置 C 中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化 C、装置 D 中观察到的现象是有固体物质生成 D、装置 D 可以采用普通玻璃管代替石英管 E、为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体 F、尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中(5)、为检验某粗硅中存在的铁元素,可采取的实验操作方法是22. A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。 (1)、若A是一种黄色单质固体,一定条件下B可以转化为C,则B→C的化学方程式为。(2)、若A是一种活泼金属,C是淡黄色固体,则C的名称为 , C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2 , 以供呼吸之用,请用化学方程式表示该反应原理。
(1)、若A是一种黄色单质固体,一定条件下B可以转化为C,则B→C的化学方程式为。(2)、若A是一种活泼金属,C是淡黄色固体,则C的名称为 , C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2 , 以供呼吸之用,请用化学方程式表示该反应原理。若生成1mol O2 , 该反应转移电子的物质的量为。
(3)、若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体。回答:①A为(填写化学式)。实验室用两种固体共热制取A,写出此化学方程式:。
②D可以转化为B,则D→B反应的离子方程式:。