备考2021年高考化学二轮专题 第4讲 反应热
试卷更新日期:2021-01-31 类型:二轮复习
一、单选题
-
1. 下列一些诗句、成语、谚语等包含吸热反应过程的是( )
①野火烧不尽,春风吹又生;②春蚕到死丝方尽,蜡炬成灰泪始干;③千锤万凿出深山,烈火焚烧若等闲;④爆竹声中一岁除,春风送暖入屠苏;⑤只要功夫深,铁杵磨成针;⑥火树银花;⑦死灰复燃;⑧凿壁借光。
A、②③⑤ B、只有③ C、⑤⑦⑧ D、③④⑤2. 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)=CO(g)+3H2(g)。反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( ) A、ΔH<0 ΔS<0 B、ΔH>0 ΔS<0 C、ΔH<0 ΔS>0 D、ΔH>0 ΔS>03. 已知可逆反应:aA+bB cC在不同温度下反应相同的时间,物质的质量分数A%和C%变化曲线如图所示,下列说法一定正确的是( )
A、ΔH<0 ΔS<0 B、ΔH>0 ΔS<0 C、ΔH<0 ΔS>0 D、ΔH>0 ΔS>03. 已知可逆反应:aA+bB cC在不同温度下反应相同的时间,物质的质量分数A%和C%变化曲线如图所示,下列说法一定正确的是( ) A、该反应的正反应是吸热反应 B、增大压强,平衡向正反应方向移动 C、该反应在T2温度时达到化学平衡 D、该反应在T1温度时正、逆反应速率相等4. N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g) CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法错误的是( )
A、该反应的正反应是吸热反应 B、增大压强,平衡向正反应方向移动 C、该反应在T2温度时达到化学平衡 D、该反应在T1温度时正、逆反应速率相等4. N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g) CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法错误的是( )
 A、ΔH = ΔH1 + ΔH2 B、ΔH = −226 kJ/mol C、该反应正反应的活化能小于逆反应的活化能 D、为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+5. 下列有关中和热概念、中和热测定实验(如图)的说法正确的是( )
A、ΔH = ΔH1 + ΔH2 B、ΔH = −226 kJ/mol C、该反应正反应的活化能小于逆反应的活化能 D、为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+5. 下列有关中和热概念、中和热测定实验(如图)的说法正确的是( ) A、已知在稀溶液中:H+(aq)+OH-(aq) =H2O(l);ΔH=-57.3kJ·mol-1 , 则有 H2SO4(aq)+ Ba(OH)2(aq)= BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1 B、已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.6kJ·mol-1 , 则该反应的中和热为114.6 kJ·mol-1。 C、中和热测定实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 D、酸碱混合时,量筒中的NaOH溶液应分多次倒入已装有盐酸的小烧杯中,并不断用环形玻璃搅拌棒搅拌。6. 下列有关说法中正确的是( )A、2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0 B、反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0 C、若ΔH > 0,ΔS < 0,化学反应在任何温度下都能自发进行 D、加入合适的催化剂能降低反应活化能,从而改变反应的焓变7. 已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )A、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1 B、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1 C、C2H2(g)+O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1 D、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-18. 化学反应N2+3H2 2NH3的能量变化如图所示,该反应的热化学方程式是( )
A、已知在稀溶液中:H+(aq)+OH-(aq) =H2O(l);ΔH=-57.3kJ·mol-1 , 则有 H2SO4(aq)+ Ba(OH)2(aq)= BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1 B、已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.6kJ·mol-1 , 则该反应的中和热为114.6 kJ·mol-1。 C、中和热测定实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 D、酸碱混合时,量筒中的NaOH溶液应分多次倒入已装有盐酸的小烧杯中,并不断用环形玻璃搅拌棒搅拌。6. 下列有关说法中正确的是( )A、2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0 B、反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0 C、若ΔH > 0,ΔS < 0,化学反应在任何温度下都能自发进行 D、加入合适的催化剂能降低反应活化能,从而改变反应的焓变7. 已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )A、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1 B、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1 C、C2H2(g)+O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1 D、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-18. 化学反应N2+3H2 2NH3的能量变化如图所示,该反应的热化学方程式是( ) A、N2(g)+3H2(g) 2NH3(l) ΔH=(a-b-c)kJ·mol-1 B、N2(g)+3H2(g) 2NH3(g) ΔH=(b+c-a)kJ·mol-1 C、N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1 D、N2(g)+H2(g) NH3(g) ΔH=(b+c+a)kJ·mol-19. 已知:2H2(g)+O2(g)= 2H2O(l),ΔH=-572kJ/mol;H—H键的键能为436kJ/mol;O=O 键的键能为498kJ/mol,则H2O分子中O—H键的键能为 ( )A、485.5 kJ/mol B、610 kJ/mol C、917 kJ/mol D、1220 kJ/mol10. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热△H=-57.3kJ·mol−1 , 则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol−1 B、甲烷的标准燃烧热ΔH=-890.3kJ·mol−1 , 则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3kJ·mol−1 C、已知:500℃、30MPa下,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol−1;将1.5molH2和过量的N2在此条件下充分反应,放出热量46.2kJ D、CO(g)的燃烧热是283.0kJ·mol−1 , 则2CO2(g) =2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−111. 强酸与强碱的稀溶液发生中和反应的热效应: ,向1L 的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应 、 、 的关系正确的是( )A、 B、 C、 D、12. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:( )
A、N2(g)+3H2(g) 2NH3(l) ΔH=(a-b-c)kJ·mol-1 B、N2(g)+3H2(g) 2NH3(g) ΔH=(b+c-a)kJ·mol-1 C、N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1 D、N2(g)+H2(g) NH3(g) ΔH=(b+c+a)kJ·mol-19. 已知:2H2(g)+O2(g)= 2H2O(l),ΔH=-572kJ/mol;H—H键的键能为436kJ/mol;O=O 键的键能为498kJ/mol,则H2O分子中O—H键的键能为 ( )A、485.5 kJ/mol B、610 kJ/mol C、917 kJ/mol D、1220 kJ/mol10. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热△H=-57.3kJ·mol−1 , 则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol−1 B、甲烷的标准燃烧热ΔH=-890.3kJ·mol−1 , 则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3kJ·mol−1 C、已知:500℃、30MPa下,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol−1;将1.5molH2和过量的N2在此条件下充分反应,放出热量46.2kJ D、CO(g)的燃烧热是283.0kJ·mol−1 , 则2CO2(g) =2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−111. 强酸与强碱的稀溶液发生中和反应的热效应: ,向1L 的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应 、 、 的关系正确的是( )A、 B、 C、 D、12. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:( )下列说法正确的是
A、 的燃烧热为 B、 反应 中的能量变化如图所示
C、 转变成 的过程一定要吸收能量
D、根据 推知反应 的
反应 中的能量变化如图所示
C、 转变成 的过程一定要吸收能量
D、根据 推知反应 的
二、填空题
-
13. 碳的化合物在生产、生活中有着重要的作用。
已知:2CO(g)+O2(g) = 2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g) = H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g) = CH3OH(g) △H3=-107kJ.molˉ1
则CH3OH(g)+O2(g) = CO2(g)+2H2O(g) △H=kJ·molˉ1
14. 在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.0kJ的热量。(1)、写出该反应的热化学方程式:。(2)、已知H2O(1)=H2O(g) △H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是 kJ。三、实验探究题
-
15. 某学习小组研究NaOH与某些酸之间的反应。(1)、Ⅰ.中和热的测定
在25℃、101 kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+ OH─(aq)= H2O(l) △H=-57.3 kJ·mol−1。按照下图所示装置进行实验。

仪器A的名称是。
(2)、碎泡沫塑料的作用是。(3)、在25℃、101 kPa条件下,取50 mL 0.50 mol·L−1 CH3COOH溶液、50 mL 0.55 mol·L−1 NaOH溶液进行实验,测得的中和热△H-57.3kJ·mol−1(填“>”“=”或“<”)。(4)、Ⅱ.某实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计方案如下(KMnO4溶液已酸化):实验序号
A溶液
B溶液
①
30 mL 0.1 mol·L-1 H2C2O4溶液
20 mL 0.01 mol.L-1 KMnO4溶液
②
30 mL 0.2 mol·L-1 H2C2O4溶液
20 mL 0.01 mol.L-1 KMnO4溶液

若反应均未结束,则相同时间内针筒中所得CO2的体积大小关系是(填实验序号)。
(5)、若实验①在2 min末注射器的活塞向右移动到了a mL的位置,则这段时间的反应速率可表示为v(CO2)=mL/min。若实验②在t min收集了4.48×10-3 L CO2(标准状况下),则t min末c( )=。(6)、该小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:① ;②反应放热使体系温度升高。四、综合题
-
16. 二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。 CO2和H2 在铁系催化剂作用下发生化学反应:
I.2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g)ΔH2>0
请回答下列问题:
(1)、反应I能自发进行,则 ΔH1 0(填“<”或“>”或“=”);该反应自发进行的条件是。(2)、在密闭容器中通入1mol CO2和3molH2 , 在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图所示。
①下列说法正确的是
A.由图1可知:0.1MPa下,200℃~550℃时以反应I为主,550℃以后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以反应II的ΔS等于零
C.恒温恒压下,容器内气体的密度不变时,说明反应已达平衡
D.其他条件不变,将CO2和H2的初始物质的量比改变为2:3,可提高CO2平衡转化率
②图1中点M(350,70)、此时乙烯的选择性为 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =。
③在图1中,温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因。
(3)、有研究表明,在铁系催化剂作用下反应I分两步进行:i CO2(g)+H2(g) CO(g)+H2O(g)慢
ii 2CO(g)+4H2(g) C2H4 (g)+2H2O(g)快
在图2中画出反应I分两步进行的“能量−反应过程图”。起点从[2CO2(g)+6H2(g)]开始。
 17. 按要求回答下列问题。(1)、在25℃、101kPa,1g液态的CH3OCH3完全燃烧放出的热量是31.74kJ。则表示CH3OCH3标准燃烧热的热化学方程式为。(2)、CH4—CO2催化重整是减少温室气体排放的重要途径。回答下列问题:
17. 按要求回答下列问题。(1)、在25℃、101kPa,1g液态的CH3OCH3完全燃烧放出的热量是31.74kJ。则表示CH3OCH3标准燃烧热的热化学方程式为。(2)、CH4—CO2催化重整是减少温室气体排放的重要途径。回答下列问题:已知:CH4(g)=C(s)+2H2(g) △H=+75.0kJ•mol-1
C(s)+O2(g)=CO2(g) △H=-394.5kJ•mol-1
C(s)+ O2(g)=CO(g) △H=-110.5kJ•mol-1
则催化重整反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的△H=kJ•mol-l;从温度和压强的角度考虑,有利于提高CH4平衡转化率的条件是。
(3)、用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A可实现氯元素的循环使用。反应A:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=-124.2kJ•mol-1
已知:
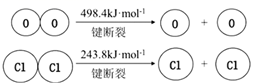
①断开1molH—O键与断开1molH—Cl键所需能量相差为 kJ。
②新型RuO2催化剂对反应A有很好的催化活性。加入催化剂后,该反应的△H(填“变大”、“变小”或“不变”)。
18. 减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。(1)、已知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式 , 该反应(填高温、低温)能自发进行。
(2)、在密闭容器中充入5molCO和4molNO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。回答下列问题:
①温度:T1T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=L/mol(保留两位有效数字);用CO的浓度变化表示的平均反应速率(CO)=。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的点。
(3)、N2O5在一定条件下可发生分解:2N2O5 4NO2(g)+O2(g),一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是(填字母)。a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2V正(NO2)=V逆(N2O5) d.气体的密度保持不变
(4)、用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2- , 则电池的正极反应式为。
-