浙教版初中科学八年级下册第三章空气与生命(1-4节)拔尖训练
试卷更新日期:2021-01-26 类型:单元试卷
一、单选题
-
1. 如图是测定空气中氧气体积分数的实验,实验后发现测定氧气的含量低于1/5,针对这一事实,下列做法和想法不可取的是( )
 A、查看实验装置是否漏气 B、将红磷改成木炭后重新实验 C、实验中红磷的量不足,没有将瓶内的氧气全部消耗尽 D、实验中可能未冷却到室温就打开止水夹,使进入瓶内的水的体积不足2. 有一份纯氯酸钾固体a,另有一份混有少量二氧化锰的氯酸钾固体b,两份固体质量相等.分别同时加热a和b,能正确表示生成氧气的质量随反应时间而变化的图象是( )A、
A、查看实验装置是否漏气 B、将红磷改成木炭后重新实验 C、实验中红磷的量不足,没有将瓶内的氧气全部消耗尽 D、实验中可能未冷却到室温就打开止水夹,使进入瓶内的水的体积不足2. 有一份纯氯酸钾固体a,另有一份混有少量二氧化锰的氯酸钾固体b,两份固体质量相等.分别同时加热a和b,能正确表示生成氧气的质量随反应时间而变化的图象是( )A、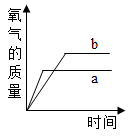 B、
B、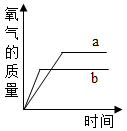 C、
C、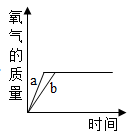 D、
D、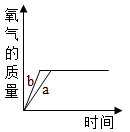 3. 下列4个图象分别表示对应的四种操作过程,其中正确的是( )A、加热氯酸钾制取氧气
3. 下列4个图象分别表示对应的四种操作过程,其中正确的是( )A、加热氯酸钾制取氧气 B、二氧化锰与氯酸钾共热时二氧化锰的质量分数随反应时间的变化图象
B、二氧化锰与氯酸钾共热时二氧化锰的质量分数随反应时间的变化图象  C、红磷在密闭容器中燃烧时容器内物质的质量变化
C、红磷在密闭容器中燃烧时容器内物质的质量变化  D、红磷在密闭容器中燃烧时氧气含量的变化情况
D、红磷在密闭容器中燃烧时氧气含量的变化情况  4. 在一密闭容器中发生某反应,其中甲、乙、丙、丁四种物质的质量变化如表所示,下列判断不正确的是( )
4. 在一密闭容器中发生某反应,其中甲、乙、丙、丁四种物质的质量变化如表所示,下列判断不正确的是( )物质
甲
乙
丙
丁
反应前质量(g)
10
16
0
0
反应中质量(g)
m2
1.6
反应后质量(g)
m1
0
15.2
6.4
A、m1 的值是 4.4 B、m2 的值是 4 C、甲和乙是反应物 D、甲、丁间反应的质量比为 7∶85. 在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表:对该反应,下列描述正确的是( )物质
甲
乙
丙
丁
反应前质量/g
20
4
20
20
反应后质量/g
2
待测
32
26
A、该反应中甲、丙、丁参与反应的质量比为1:16:13 B、乙在该反应中一定是催化剂 C、待测质量为2 g D、该反应一定是分解反应6. 在一密闭容器中,有甲、乙、丙、丁四种物质,反应前,它们的质量如白色条形图所示,反应结束后,它们的质量如黑色条形图所示。下列说法正确的是( ) A、该反应为化合反应 B、丙一定是该反应的催化剂 C、甲、乙的相对分子质量之比一定为2∶3 D、反应过程中甲和丁变化的质量比为2∶17. 有A、B两种混合粉末,质量分别为m1、m2。A由CaCO3和KHCO3组成,B由MgCO3和NaHCO3组成。将A、B分别与足量稀盐酸反应,生成二氧化碳气体的质量均为w克(已知:KHCO3+HCl=KCl+CO2↑+H2O;NaHCO3+HCl=NaCl+CO2↑+H2O)。下列说法正确的是( )A、25m1=21m2 B、混合物A中CaCO3和KHCO3的质量比一定为1∶1 C、m1=m2 D、混合物B中MgCO3和NaHCO3的质量比可为任意比8. 下列有关催化剂的说法正确的是( )A、不使用催化剂,物质就不能发生化学反应 B、催化剂只能加快反应速率 C、催化剂能改变其它物质的反应速率 D、用催化剂将水变成汽油9. 在试管甲中放入15g氯酸钾,试管乙中放入15g氯酸钾和一定量MnO2 , 分别加热并充分反应。下图对该实验产生气体的质量与反应时间的关系,合理的是( )A、
A、该反应为化合反应 B、丙一定是该反应的催化剂 C、甲、乙的相对分子质量之比一定为2∶3 D、反应过程中甲和丁变化的质量比为2∶17. 有A、B两种混合粉末,质量分别为m1、m2。A由CaCO3和KHCO3组成,B由MgCO3和NaHCO3组成。将A、B分别与足量稀盐酸反应,生成二氧化碳气体的质量均为w克(已知:KHCO3+HCl=KCl+CO2↑+H2O;NaHCO3+HCl=NaCl+CO2↑+H2O)。下列说法正确的是( )A、25m1=21m2 B、混合物A中CaCO3和KHCO3的质量比一定为1∶1 C、m1=m2 D、混合物B中MgCO3和NaHCO3的质量比可为任意比8. 下列有关催化剂的说法正确的是( )A、不使用催化剂,物质就不能发生化学反应 B、催化剂只能加快反应速率 C、催化剂能改变其它物质的反应速率 D、用催化剂将水变成汽油9. 在试管甲中放入15g氯酸钾,试管乙中放入15g氯酸钾和一定量MnO2 , 分别加热并充分反应。下图对该实验产生气体的质量与反应时间的关系,合理的是( )A、 B、
B、 C、
C、 D、
D、 10.
10.如右图,某同学用燃烧红磷的方法测定空气中氧气的体积分数,实验后发现测得的氧气体积分数小于1/5,对此,你认为下列做法或想法不可取的是( )
 A、查看实验装置是否漏气 B、将红磷改成木炭后重新实验 C、实验中红磷的量不足,没有将瓶内的氧气全部消耗尽 D、实验中可能未冷却到室温就打开止水夹,使进入瓶内的水的体积不足11.
A、查看实验装置是否漏气 B、将红磷改成木炭后重新实验 C、实验中红磷的量不足,没有将瓶内的氧气全部消耗尽 D、实验中可能未冷却到室温就打开止水夹,使进入瓶内的水的体积不足11.在科学活动周中,某校兴趣小组同学在(培养中学生基本科学素养的化学实验教学研究)课题组老师的指导下,将课本“测定空气中氧气的含量”实验装置(如甲图)改进为新的实验装置(如乙图),改进后的实验装置相对于原装置,以下评价不恰当的是( )
 A、反应容器体积小,药品消耗少 B、装置简洁,减少了甲图装置中导管引起的误差 C、白磷比红磷着火点高,使用更安全 D、容器内径相等,易准确推算出空气中氧气的含量12. 30克不纯的铁与足量的稀盐酸反应,产生了1克氢气,则该铁样品中含的杂质可能是( )A、Cu B、Mg C、Al D、Na13. 现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中( )
A、反应容器体积小,药品消耗少 B、装置简洁,减少了甲图装置中导管引起的误差 C、白磷比红磷着火点高,使用更安全 D、容器内径相等,易准确推算出空气中氧气的含量12. 30克不纯的铁与足量的稀盐酸反应,产生了1克氢气,则该铁样品中含的杂质可能是( )A、Cu B、Mg C、Al D、Na13. 现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中( )
A、碳酸钠消耗的氯化氢多 B、碳酸钠生成的二氧化碳多 C、碳酸氢钠消耗的氯化氢多 D、碳酸氢钠生成的二氧化碳多14.已知:2KClO3
 2KCl+3O2↑,如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
2KCl+3O2↑,如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( ) A、固体中氧元素的质量 B、生成O2的质量 C、固体中MnO2的质量 D、固体中钾元素的质量15. 在一定条件下,一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示.下列有关说法不正确的是( )
A、固体中氧元素的质量 B、生成O2的质量 C、固体中MnO2的质量 D、固体中钾元素的质量15. 在一定条件下,一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示.下列有关说法不正确的是( )物质
a
b
c
d
反应前的质量/g
30
20
10
15
反应后的质量/g
X
y
0
10
A、参加反应的c与d的质量比为2:1 B、x的取值范围:0≤x≤30 C、当y≤20时,该反应一定是化合反应 D、x+y=6516. 在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表.已知甲的相对分子质量为丁的2倍.则下列说法不正确的是( )甲的质量/g
乙的质量/g
丙的质量/g
丁的质量/g
反应前
64
10
1
16
t时刻
32
a
反应后
0
54
b
0
A、乙和丙为生成物 B、a等于32 C、b等于37 D、该反应方程式中甲与丁的化学计量数之比为1:217. 质量守恒定律是帮助我们认识化学反应实质的重要理论.某物质R与水和氧气反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4则R的化学式应为( )A、FeS B、Fe2S3 C、FeO D、FeS218. 在反应2A+3B=2C+4D中,若 A、B、C、D的质量比为8∶12∶11∶9,则A、B、C、D的相对分子质量之比为( )A、8∶12∶11∶9 B、16∶36∶22∶36 C、16∶16∶22∶9 D、2∶3∶2∶419. 在反应2A+3B=2C+4D中,A与B的相对分子质量之比为1:1,用一定质量的A与12克B恰好完全反应,生产11克C,则下列说法中错误的是( )A、若A的相对分子质量是32,则C的相对分子质量是88 B、B与D的相对分子质量之比是16:9 C、同时生成D的质量是9克 D、反应中,A与C的质量之比是8:1120.如图所示装置,有洗气、储气等用途,在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水。以下说法正确的是( )
 A、b导管连接供给氧气的钢瓶 B、a导管连接病人吸氧气的塑胶管 C、该装置可用来观察是否有氧气输出 D、该装置不能用来观察输出氧气的速度21. 下列制备氧气的反应中,用等质量的反应物能获得氧气最多的是()A、2H2O2
A、b导管连接供给氧气的钢瓶 B、a导管连接病人吸氧气的塑胶管 C、该装置可用来观察是否有氧气输出 D、该装置不能用来观察输出氧气的速度21. 下列制备氧气的反应中,用等质量的反应物能获得氧气最多的是()A、2H2O2 2H2O+O2↑
B、2KClO3
2H2O+O2↑
B、2KClO3  2KCl+3O2↑
C、2H2O
2KCl+3O2↑
C、2H2O  2H2↑+O2↑
D、2KMnO4 △ K2MnO4+MnO2+O2↑
22.
2H2↑+O2↑
D、2KMnO4 △ K2MnO4+MnO2+O2↑
22.某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表.根据表中信息,判断下列说法正确的是()
 A、该反应为置换反应 B、X中一定含有碳、氢两种元素 C、表中“待测”值为5 D、反应生成的CO2和H2O的质量比为45:3623. 如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是( )
A、该反应为置换反应 B、X中一定含有碳、氢两种元素 C、表中“待测”值为5 D、反应生成的CO2和H2O的质量比为45:3623. 如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是( )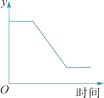 A、固体中氧元素的质量 B、生成O2的质量 C、固体中MnO2的质量 D、固体中钾元素的质量分数24. 把盛有水的纸盒放在火上烧水,烧开了纸盒仍不会烧着这是因为( )
A、固体中氧元素的质量 B、生成O2的质量 C、固体中MnO2的质量 D、固体中钾元素的质量分数24. 把盛有水的纸盒放在火上烧水,烧开了纸盒仍不会烧着这是因为( )
A、水能够灭火,所以纸盒不会烧着 B、火焰的温度较低,低于纸的着火温度 C、纸的着火温度较高,高于水的沸点 D、水善于将热量迅速向外散发,所以纸盒不会烧着二、实验探究题
-
25. 请根据下列装置图回答问题:
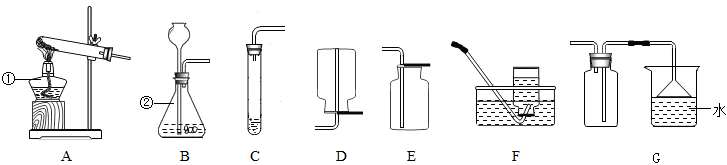 (1)、写出图中仪器①、②的名称:①;②。(2)、实验室用高锰酸钾制取氧气,可选用的气体发生装置为 (填字母,下同),气体收集装置为或;该装置中,固定仪器时的一条主要注意事项是。(3)、实验室用高锰酸钾制取氧气时,试管口处要 。
(1)、写出图中仪器①、②的名称:①;②。(2)、实验室用高锰酸钾制取氧气,可选用的气体发生装置为 (填字母,下同),气体收集装置为或;该装置中,固定仪器时的一条主要注意事项是。(3)、实验室用高锰酸钾制取氧气时,试管口处要 。
(4)、实验室加热高锰酸钾制取氧气(用排水法收集)的主要步骤有:①装入药品;②检查装置气密性;③收集气体;④加热;⑤停止加热;⑥移出导气管。正确的操作顺序为A、①②③④⑤⑥ B、②①③④⑥⑤ C、②①④③⑤⑥ D、②①④③⑥⑤(5)、若使用B装置来进行二氧化锰和过氧化氢制取氧气的实验,在该反应中二氧化锰是;该反应的文字表达式为。(6)、经查资料可知,NH3的密度比空气小,极易溶于水,有刺激性气味。实验室常用加热氯化铵和氢氧化钙固体的方法来制取NH3 , 选用装置作制取氨气的发生装置,最好选用装置来收集NH3 , 理由是26. 实验室制取氧气的两种方法如下:方法一:H2O2 H2O+O2
方法二:KMnO4 K2MnO4+MnO2+O2
(1)、两种方法涉及的化学反应都是反应。(2)、如图是实验室制取、干燥和收集气体的装置图。仪器A的名称是 , 现用方法一制取一瓶干燥的氧气,请按气体流向,用导管的编号将装置连接好。(浓硫酸具有吸水性,可作干燥剂) 27.
27.如图是实验室制取气体的常用装置,请回答下列问题:
 (1)、写出带有标号的仪器名称① ,② .(2)、写出一个实验室制取氧气的化学方程式 ,用该方法制取氧气所选择的发生装置是 .若用排水法收集氧气,判断气瓶内氧气已收集满的依据是 .(3)、实验室制取二氧化碳,可选择发生装置为 .若要收集一瓶纯净、干燥的二氧化碳气体,请按照气流从左到右的方向,用仪器接口字母表示连接顺序.
(1)、写出带有标号的仪器名称① ,② .(2)、写出一个实验室制取氧气的化学方程式 ,用该方法制取氧气所选择的发生装置是 .若用排水法收集氧气,判断气瓶内氧气已收集满的依据是 .(3)、实验室制取二氧化碳,可选择发生装置为 .若要收集一瓶纯净、干燥的二氧化碳气体,请按照气流从左到右的方向,用仪器接口字母表示连接顺序.发生装置端口→ ( )→( )→( )→( )→( ) .
(4)、检验二氧化碳气体的方法是 .(用化学方程式表示)28.如图是初中化学实验室常见气体的制取装置:
 (1)、实验室制取氧气的原理之一是 (用化学方程式表示),此原理对应的发生装置是 (填序号〕.用D装置收集氧气,验满的方法是;(2)、收集二氧化碳应选择的装置为 (填序号).理由是 , 欲收集一瓶干燥的二氧化碳,还需选用E装置,则E中应装入的药品是 .29.
(1)、实验室制取氧气的原理之一是 (用化学方程式表示),此原理对应的发生装置是 (填序号〕.用D装置收集氧气,验满的方法是;(2)、收集二氧化碳应选择的装置为 (填序号).理由是 , 欲收集一瓶干燥的二氧化碳,还需选用E装置,则E中应装入的药品是 .29.根据所学的知识并结合图1仪器,回答有关问题:
 (1)、写出仪器A的名称;(2)、实验室以氯酸钾为原料制取并收集氧气,完成这个实验除选用A、D、E、F、I外,还需增加的仪器是 ,反应的化学方程式为 ;(3)、实验室用石灰石和稀盐酸制取二氧化碳,组装一套气体发生装置所需的仪器是 (填字母),反应的化学方程式为 ;(4)、通过查阅资料获知:镁在加热条件下与O2、N2、CO2、H2O均能发生反应;氮化镁(Mg3N2)能与水反应;碱石灰的主要成分是生石灰和氢氧化钠固体,小强欲在实验室里以空气和镁粉为原料制取少量氮化镁,可供选择的装置和药品如图2所示.
(1)、写出仪器A的名称;(2)、实验室以氯酸钾为原料制取并收集氧气,完成这个实验除选用A、D、E、F、I外,还需增加的仪器是 ,反应的化学方程式为 ;(3)、实验室用石灰石和稀盐酸制取二氧化碳,组装一套气体发生装置所需的仪器是 (填字母),反应的化学方程式为 ;(4)、通过查阅资料获知:镁在加热条件下与O2、N2、CO2、H2O均能发生反应;氮化镁(Mg3N2)能与水反应;碱石灰的主要成分是生石灰和氢氧化钠固体,小强欲在实验室里以空气和镁粉为原料制取少量氮化镁,可供选择的装置和药品如图2所示.①导管口之间的连接顺序是:a→ 、→、→、→h.
②通气后,应先点燃装置 (填“B”或“C”)的酒精灯,装置E的作用是 .
30.结合如图1几种实验装置,回答有关问题:
 (1)、写出编号仪器的名称:① , ② .(2)、实验室用大理石和稀盐酸制取二氧化碳,反应的化学方程式为 ;用A装置制取二氧化碳,收集气体时,集气瓶中导气管口应处的位置是 (选填“a”或“b”),此装置不能控制反应的发生和停止,若要随时控制反应发生或停止,应选用的装置是 (填写字母).(3)、若用图2装置检验制取的二氧化碳气体中是否含有氯化氢和水蒸气,写出气体通过装置的接口顺序 (用“a”、“b”、“c”、“d”表示).
(1)、写出编号仪器的名称:① , ② .(2)、实验室用大理石和稀盐酸制取二氧化碳,反应的化学方程式为 ;用A装置制取二氧化碳,收集气体时,集气瓶中导气管口应处的位置是 (选填“a”或“b”),此装置不能控制反应的发生和停止,若要随时控制反应发生或停止,应选用的装置是 (填写字母).(3)、若用图2装置检验制取的二氧化碳气体中是否含有氯化氢和水蒸气,写出气体通过装置的接口顺序 (用“a”、“b”、“c”、“d”表示).三、解答题
-
31. 科学兴趣小组对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究,测定石头纸中碳酸钙的质量分数。
实验方法是:均匀称取七份样品分别和稀盐酸反应(CaCO3+2HCl=CaCl2+H2O+CO2↑),用电子天平及有关装置进行实验,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
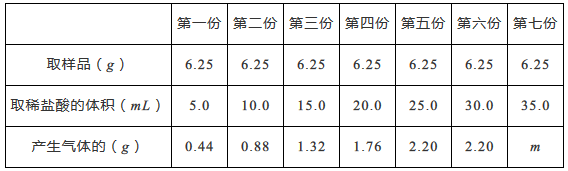
通过对数据的分析和比较,回答下列有关问题
 (1)、m为。(2)、石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)(3)、在坐标图中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图。32. 实验室通常用化学方法制取氧气,某同学取质量为m 的高锰酸钾固体加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题:
(1)、m为。(2)、石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)(3)、在坐标图中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图。32. 实验室通常用化学方法制取氧气,某同学取质量为m 的高锰酸钾固体加热,记录产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题: (1)、t0—t1时段氧气的质量未增加,其原因可能是 t0—t1时段;(2)、请根据图中数据计算高锰酸钾的质量m为多少?(写出计算过程)33. 某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。求:
(1)、t0—t1时段氧气的质量未增加,其原因可能是 t0—t1时段;(2)、请根据图中数据计算高锰酸钾的质量m为多少?(写出计算过程)33. 某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。求: (1)、生成CO2的质量。(2)、该纯碱样品中Na2CO3的质量分数。(3)、求反应后所得NaCl溶液的质量分数。34. 实验室制取氧气时,某同学取一定质量的氯酸钾和二氧化锰混合,加热并进行测量记录,反应产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题: (反应的化学方程式为:2KClO3 2KCl+3O2↑)
(1)、生成CO2的质量。(2)、该纯碱样品中Na2CO3的质量分数。(3)、求反应后所得NaCl溶液的质量分数。34. 实验室制取氧气时,某同学取一定质量的氯酸钾和二氧化锰混合,加热并进行测量记录,反应产生氧气的质量与反应时间的关系如图甲所示,请回答下列问题: (反应的化学方程式为:2KClO3 2KCl+3O2↑)
 (1)、t0-t1和t4-t3时段固体质量都不变,为什么?(2)、请根据图中数据计算混合物中氯酸钾的质量多少?(写出计算过程)(3)、请在图乙的坐标中,画出固体中钾元素质量在t0-t5时段变化的示意图。35. 为了测定石灰石中碳酸钙的含量,小东进行了如下实验;取10.0g石灰石放于烧杯中,向烧杯中滴加稀盐酸,实验测得烧杯中剩余物质的质量与加入稀盐酸的质量之间的关系如图所示。整个过程不考虑稀盐酸的挥发和气体的溶解,石灰石中的杂质也不与稀盐酸反应。求:
(1)、t0-t1和t4-t3时段固体质量都不变,为什么?(2)、请根据图中数据计算混合物中氯酸钾的质量多少?(写出计算过程)(3)、请在图乙的坐标中,画出固体中钾元素质量在t0-t5时段变化的示意图。35. 为了测定石灰石中碳酸钙的含量,小东进行了如下实验;取10.0g石灰石放于烧杯中,向烧杯中滴加稀盐酸,实验测得烧杯中剩余物质的质量与加入稀盐酸的质量之间的关系如图所示。整个过程不考虑稀盐酸的挥发和气体的溶解,石灰石中的杂质也不与稀盐酸反应。求: (1)、产生CO2的总质量为g。(2)、石灰石中碳酸钙的质量分数(写出计算过程)。36.
(1)、产生CO2的总质量为g。(2)、石灰石中碳酸钙的质量分数(写出计算过程)。36.实验室有铁粉和铜粉的固体混合物,现取10g置于烧杯中,向烧杯中加入一定溶质质量分数的稀硫酸,烧杯内固体质量与加入稀硫酸的质量关系如图所示,请完成下列问题:
 (1)、固体样品中铜的质量为 g.(2)、求恰好完全反应时所得溶液中溶质的质量分数.(3)、B点溶液中的溶质是 .37.
(1)、固体样品中铜的质量为 g.(2)、求恰好完全反应时所得溶液中溶质的质量分数.(3)、B点溶液中的溶质是 .37.将4g含有可溶性杂质的硫酸铜样品溶于足量水,再向所得溶液中逐渐滴加75g一定溶质质量分数的氯化钡溶液(杂质不与氯化钡溶液反应),实验过程中,生成沉淀的质量与滴入氯化钡溶液的质量关系如图所示.试计算:
 (1)、恰好完全反应时,生成沉淀质量为 g;(2)、样品中硫酸铜的质量分数是多少?(3)、反应后溶液中,氯化钡的质量是多少?38.
(1)、恰好完全反应时,生成沉淀质量为 g;(2)、样品中硫酸铜的质量分数是多少?(3)、反应后溶液中,氯化钡的质量是多少?38.为测定某AgNO3溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定.现取待测液50.0g,滴定过程如图所示.
(滴定反应为:AgNO3+HCl=AgCl↓+HNO3 , Ag的相对原子质量为108,计算结果均保留1位小数)
 (1)、AgNO3的相对分子质量为: ;(2)、计算AgNO3溶液的溶质质量分数;(3)、计算恰好完全反应时,所得溶液的溶质质量分数.
(1)、AgNO3的相对分子质量为: ;(2)、计算AgNO3溶液的溶质质量分数;(3)、计算恰好完全反应时,所得溶液的溶质质量分数.