山西省太原市2020-2021学年高二上学期化学期中考试试卷(理)
试卷更新日期:2021-01-26 类型:期中考试
一、单选题
-
1. 2020年7月,由“长征五号”运载火箭搭载的我国首个火星探测器“天问一号”成功发射。该火箭使用的无毒燃料是液氢和航天煤油,下列说法错误的是( )
 A、火箭燃料燃烧时,化学能转化为热能 B、液氢和航天煤油燃烧时,均作还原剂 C、航天煤油可通过石油干馏得到 D、与航天煤油相比,液氢燃烧后的产物对环境影响较小2. 下列电离方程式正确的是( )A、NaHCO3溶于水:NaHCO3 Na++ B、NaHSO4溶于水:NaHSO4=Na++H++ C、HF溶于少量水:HF=H++F- D、H2CO3溶液:H2CO3=2H++3. 下列措施与控制化学反应速率无关的是( )A、汽车加大油门 B、使用加酶洗衣粉 C、搅拌使食盐在水中溶解 D、在月饼包装中放置脱氧剂4. 下列事实一定能说明亚硝酸(HNO2)是弱电解质的是( )
A、火箭燃料燃烧时,化学能转化为热能 B、液氢和航天煤油燃烧时,均作还原剂 C、航天煤油可通过石油干馏得到 D、与航天煤油相比,液氢燃烧后的产物对环境影响较小2. 下列电离方程式正确的是( )A、NaHCO3溶于水:NaHCO3 Na++ B、NaHSO4溶于水:NaHSO4=Na++H++ C、HF溶于少量水:HF=H++F- D、H2CO3溶液:H2CO3=2H++3. 下列措施与控制化学反应速率无关的是( )A、汽车加大油门 B、使用加酶洗衣粉 C、搅拌使食盐在水中溶解 D、在月饼包装中放置脱氧剂4. 下列事实一定能说明亚硝酸(HNO2)是弱电解质的是( )①常温下HNO2溶液中存在的微粒有:H+、NO 、HNO2 , OH-、H2O
②用HNO2溶液做导电性实验,灯泡很暗
③10mL1 mol∙L−1HNO2溶液恰好与10mL1 mol∙L−1NaOH溶液完全反应
④0.1 mol∙L−1HNO2溶液的c(H+)<0.1 mol∙L−1
A、①③ B、②③ C、①④ D、②④5. 下列事实不能用勒夏特列原理解释的是( )A、H2(g)+I2(g) 2HI(g)反应达平衡后,压缩体积气体颜色变深 B、Fe(SCN)3溶液中加入固体KSCN后颜色变深 C、N2(g)+3H2(g) 2NH3(g)△H<0,工业上采用高压条件更有利于合成氨 D、浸泡在冰水中的NO2球的红棕色明显变浅6. 下列反应的反应热属于燃烧热的是( )A、Na(s)+ Cl2(g)=NaCl(s)△H1 B、2Na(s)+ O2(g)=Na2O(s)△H2 C、2Na(s)+O2(g)=Na2O2(s)△H3 D、CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H4(已知CH3OCH3沸点为-24.9℃)7. 环戊二烯( )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。已知:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。已知: ①
 (g)=
(g)=  (g)+H2(g)△H1=+100.3kJ·mol-1
(g)+H2(g)△H1=+100.3kJ·mol-1②H2(g)+I2(g)=2HI(g)△H2=-11.0kJ·mol-1
则反应
 (g)+I2(g)=
(g)+I2(g)=  (g)+2HI(g)的△H等于( )A、+89.3kJ·mol-1 B、-89.3kJ·mol-1 C、+111.3kJ·mol-1 D、-111.3kJ·mol-18. 我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到:C2H6(g) C2H4(g)+H2(g),相关化学键的键能数据如下表所示,则上述反应的△H等于( )
(g)+2HI(g)的△H等于( )A、+89.3kJ·mol-1 B、-89.3kJ·mol-1 C、+111.3kJ·mol-1 D、-111.3kJ·mol-18. 我国是世界上第二大乙烯生产国,乙烯可由乙烷裂解得到:C2H6(g) C2H4(g)+H2(g),相关化学键的键能数据如下表所示,则上述反应的△H等于( )化学键
C-H
C-C
C=C
H-H
键能/(kJ•mol-1)
412
348
612
436
A、-124kJ·mol-1 B、+124kJ·mol-1 C、-288kJ·mol-1 D、+288kJ·mol-19. 下列关于平衡常数的说法正确的是:( )A、K不变,平衡可能移动 B、同一个反应的化学计量数增大2倍,K值也增大两倍 C、K值越大,反应速率也越快 D、对于合成氨反应,压强增大,平衡右移,K增大10. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g),下列判断正确的是( )A、增加Ni的用量,可加快该反应速率 B、该反应达到平衡时,4v正[Ni(CO)4]=v逆(CO) C、减小压强,正反应速率减小,逆反应速率增大 D、选择合适的催化剂可提高CO的平衡转化率11. 已知反应:2NO(g)+Br2(g)=2NOBr(g) △H=-akJ·mol-1(a>0),其反应机理如下:①NO(g)+Br2(g)=NOBr2(g) △H1快反应;
②NO(g)+NOBr2(g)=2NOBr(g) △H2慢反应。
下列说法错误的是( )
A、△H=△H1+△H2 B、该反应的速率主要取决于反应① C、NOBr2是该反应的中间产物,不是催化剂 D、恒容时,增大Br2(g)的浓度能增加单位体积活化分子总数,加快反应速率12. 某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。下列说法错误的是( ) A、HAP能提高HCHO与O2的反应速率 B、HCHO在反应过程中,有C—H键发生断裂 C、根据图示信息,CO2分子中的氧原子全部来自O2 D、该反应可表示为:HCHO+O2 CO2+H2O13. 一定温度和压强下,当△H-T△S<0时,反应能自发进行。下列反应△H>0,△S>0的是( )A、HCl(g)+NH3(g)=NH4Cl(s) B、高温下能自发进行的反应:2N2O5(g)=4NO2(g)+O2(g) C、2H2(g)+O2(g)=2H2O(l) D、任何温度下均能自发进行的反应:COCl2(g)=CO(g)+Cl2(g)14. 一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-905.9 kJ∙mol−1 , 下列叙述正确的是( )A、4molNH3和5molO2充分反应,达到平衡时放出的热量为905.9kJ B、平衡时υ正(O2)= υ逆(NO) C、平衡后减小压强,混合气体的平均摩尔质量增大 D、平衡后升高温度,混合气体中NO的体积分数降低15. 可逆反应: 在恒容容器中进行,达到平衡状态的标志是( )
A、HAP能提高HCHO与O2的反应速率 B、HCHO在反应过程中,有C—H键发生断裂 C、根据图示信息,CO2分子中的氧原子全部来自O2 D、该反应可表示为:HCHO+O2 CO2+H2O13. 一定温度和压强下,当△H-T△S<0时,反应能自发进行。下列反应△H>0,△S>0的是( )A、HCl(g)+NH3(g)=NH4Cl(s) B、高温下能自发进行的反应:2N2O5(g)=4NO2(g)+O2(g) C、2H2(g)+O2(g)=2H2O(l) D、任何温度下均能自发进行的反应:COCl2(g)=CO(g)+Cl2(g)14. 一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H=-905.9 kJ∙mol−1 , 下列叙述正确的是( )A、4molNH3和5molO2充分反应,达到平衡时放出的热量为905.9kJ B、平衡时υ正(O2)= υ逆(NO) C、平衡后减小压强,混合气体的平均摩尔质量增大 D、平衡后升高温度,混合气体中NO的体积分数降低15. 可逆反应: 在恒容容器中进行,达到平衡状态的标志是( )①单位时间内生成 的同时生成
②单位时间内生成 的同时生成
③用 、 、 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A、①④⑥ B、②③⑤ C、①③④ D、①②③④⑤⑥16. K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验: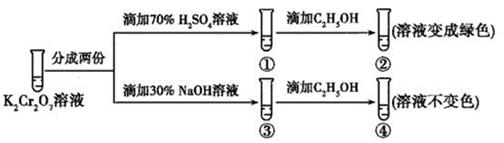
结合实验,下列说法错误的是( )
A、①中溶液橙色加深,③中溶液变黄 B、②中Cr2O72-被C2H5OH还原 C、对比②和④可知K2Cr2O7酸性溶液氧化性强 D、若向④中加入70%H2SO4溶液至过量,溶液变为橙色17. 电解质溶液的导电能力(用电导率表示,且电导率越大溶液的导电能力越强)与很多因素有关,其中之一是离子的种类,如图所示(HAc代表醋酸)。下列说法正确的是( ) A、强酸的电导率最大,强碱次之,盐类较低 B、浓度相同时,H2SO4溶液的导电能力可能大于Na2SO4溶液 C、强电解质溶液的导电能力一定比弱电解质溶液强 D、氨水加水稀释或加酸中和后,溶液的导电能力均下降18. 由表格中的电离常数判断下列反应可以发生的是( )
A、强酸的电导率最大,强碱次之,盐类较低 B、浓度相同时,H2SO4溶液的导电能力可能大于Na2SO4溶液 C、强电解质溶液的导电能力一定比弱电解质溶液强 D、氨水加水稀释或加酸中和后,溶液的导电能力均下降18. 由表格中的电离常数判断下列反应可以发生的是( )弱酸
HClO
H2CO3
电离常数(25℃)
K=3.2×10-8
K1=4.3×10-7
K2=4.7×10-11
A、NaClO+NaHCO3=HClO+Na2CO3 B、NaClO+CO2+H2O=HClO+NaHCO3 C、2NaClO+CO2+H2O=2HClO+Na2CO3 D、HClO+NaHCO3=NaClO+CO2↑+H2O19. 碳酸钠作为固硫剂并用氢气还原辉钼矿(主要成分为MoS2)的原理为MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)。实验测得平衡时气体的体积分数随温度变化曲线如图,已知A点压强为0.1MPa,则该点对应的平衡常数Kp为( )
(提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数) A、4×10-4(MPa)2 B、4×10-3(MPa)2 C、2×10-2(MPa)2 D、2×10-2MPa20. T℃时,将6molCO2和8molH2充入2L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化,下列说法正确的是( )
A、4×10-4(MPa)2 B、4×10-3(MPa)2 C、2×10-2(MPa)2 D、2×10-2MPa20. T℃时,将6molCO2和8molH2充入2L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化,下列说法正确的是( ) A、曲线II对应的条件改变是降低压强 B、若曲线I对应的条件改变是升温,则该反应△H>0 C、反应开始至a点时v(H2)=0.5mol·L-1·min-1 D、T℃时,该反应的化学平衡常数的值为0.5
A、曲线II对应的条件改变是降低压强 B、若曲线I对应的条件改变是升温,则该反应△H>0 C、反应开始至a点时v(H2)=0.5mol·L-1·min-1 D、T℃时,该反应的化学平衡常数的值为0.5二、综合题
-
21. 在一定温度下,将4.0molSO2与2.0molO2的混合气体充入容积为2L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),经过2min达到平衡状态,SO2的平衡转化率为90.0%。(1)、0~2min内O2的平均反应速率v(O2)=。(2)、该温度下此反应的化学平衡常数的值K=。(3)、在相同温度下,某容器内c(SO2)=c(O2)=c(SO3)=1.0mol·L-1 , 则此时反应速率v正v逆(填“>”、“<”或“=”)。(4)、在一定温度下,下列措施可以提高SO2转化率的是___ (填字母)。A、增大SO2的浓度 B、容积不变,充入氖气 C、增大O2的浓度 D、容积不变,再充入4.0molSO2与2.0molO222.(1)、现有下列物质:①HNO3②冰醋酸③氨水④Al(OH)3⑤NaHCO3(s)⑥Cu⑦氯水⑧CaCO3⑨H2CO3。其中属于强电解质的有 (填序号,下同),属于弱电解质的有。(2)、在一定温度下,有c(H+)均为0.01mol·L-1的:三种酸:a.盐酸b.硫酸c.醋酸,取等体积的三种溶液:
①中和三种酸所需NaOH的物质的量由大到小的顺序是。(用“a”、“b”、“c”填空,下同)
②分别加入表面积相同的Zn粒,相同条件下产生相同体积的氢气,速率由大到小的顺序是。
(3)、在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力变化如图。
①ab、c三点中酸性最强的是。
②若使c点溶液中的c(CH3COO-)变大,可采取的措施是 (填字母)。
A.适当加热
B.加大量很稀的NaOH溶液
C.加少量固体KOH
D.加一定量水
E.加少量固体CH3COONa
F.加Zn粒
③25℃时,体积均为10mL、c(H+)均为0.01mol·L-1的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程中pH的变化如图所示。已知:pH=-lgc(H+),则:25℃时,醋酸的电离常数。(填“>”、“<”或“=”)HX的电离常数
 23. 能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。(1)、下列做法有助于能源“开源节流”的是 (填字母)。
23. 能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。(1)、下列做法有助于能源“开源节流”的是 (填字母)。a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源
d.减少资源消耗,增加资源的重复使用和循环再生
(2)、金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
①在通常状况下, (填“金刚石”或“石墨”)更稳定;石墨的燃烧热△H为。
②若12g金刚石在24g氧气中燃烧,生成气体36g,则该过程放出的热量为。
(3)、已知:N2、O2分子中化学键的键能分别是946mol·L-1、497mol·L-1 , N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1 , 则NO分子中化学键的键能为kJ·mol-1。(4)、综合上述有关信息,请写出CO和NO反应生成两种无毒气体的热化学方程式:。24. 某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO的工艺,其氧化过程的反应原理及反应热、活化能数据如下:反应I:NO(g)+O3(g) NO2(g)+O2(g)△H1=-200.9kJ·mol-1 , E1=3.2kJ·mol-1
反应II:SO2(g)+O3(g) SO3(g)+O2(g)△H2=-241.6kJ·mol-1 , E2=58kJ·mol-1
已知该体系中臭氧发生分解反应:2O3(g) 3O2(g)。
保持其他条件不变,每次向容积为2L的反应器中充入含2.0molNO、2.0molSO2的模拟烟气和4.0molO3 , 改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:
 (1)、臭氧氧化过程不能有效地脱硫,但后续步骤“碱吸收”可以有效脱硫。写出利用氨水吸收SO3的离子方程式:。(2)、由图可知相同温度下NO的转化率远高于SO2 , 其可能原因是。(3)、若其他条件不变时,缩小反应器的容积,可提高NO和SO2的转化率,请解释原因:。(4)、假设100℃时,P、Q均为平衡点,此时发生分解反应的O3占充入O3总量的10%,体系中剩余O3的物质的量是。试分析反应II中SO2转化率随温度变化先增大后减小的可能原因:。25. 某兴趣小组为探究外界条件对化学反应速率的影响,设计的实验方案如下:
(1)、臭氧氧化过程不能有效地脱硫,但后续步骤“碱吸收”可以有效脱硫。写出利用氨水吸收SO3的离子方程式:。(2)、由图可知相同温度下NO的转化率远高于SO2 , 其可能原因是。(3)、若其他条件不变时,缩小反应器的容积,可提高NO和SO2的转化率,请解释原因:。(4)、假设100℃时,P、Q均为平衡点,此时发生分解反应的O3占充入O3总量的10%,体系中剩余O3的物质的量是。试分析反应II中SO2转化率随温度变化先增大后减小的可能原因:。25. 某兴趣小组为探究外界条件对化学反应速率的影响,设计的实验方案如下:实验编号
H2C2O4溶液
酸性KMnO4溶液
温度/℃
浓度/(mol•L-1)
体积/mL
浓度/(mol•L-1)
体积/mL
①
0.10
2.0
0.01
3.0
25
②
0.20
2.0
0.01
3.0
25
③
0.20
2.0
0.01
3.0
50
(1)、实验时发生反应的化学方程式为;为了顺利观察到KMnO4紫色褪去,起始时需要满足n(H2C2O4):n(KMnO4)≥。(2)、探究反应物浓度对反应速率影响的是实验(填编号,下同),探究反应温度对反应速率影响的是实验。(3)、测得实验①中溶液褪色的时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=。(4)、实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是。(5)、草酸又称乙二酸,是一种二元弱酸。写出草酸在水中的第一步电离方程式: , 该步电离的平衡常数表达式K1=。26. 某研究小组为了验证反应物浓度对反应速率的影响,在室温下向2mL0.001mol·L-1KMnO4溶液中分别加入不同浓度的草酸溶液2mL,实验结果如图1;若上述实验中使用的是含20%硫酸的0.001mol·L-1KMnO4溶液,实验结果如图2。回答有关问题:
已知:草酸与高锰酸钾反应的过程可能为:Mn(VII)(VII表示价态,下同) Mn(VI) Mn(IV) Mn(III) Mn(III)(C2O4)n3-2n2(红色)→Mn(II)+2nCO2
(1)、实验时发生总反应的离子方程式为。(2)、由题可知,Mn(II)的作用是;由图2可知,在当前实验条件下,增大草酸的浓度,褪色时间(填“变大”、“变小”或“不变”)。(3)、对比图1和图2,该小组同学推测酸化有利于提高该反应的速率。为了验证该推测,设计了系列实验,记录如下(均在室温下进行):试管编号
0.01mol•L-1KMnO4溶液/mL
0.2mol•L-1
H2C2O4溶液/mL
蒸馏水/mL
2.0mol•L-1H2SO4溶液/mL
A
4.0
2.0
2.0
0
B
V1
V2
1.5
V3
C
V4
2.0
V5
1.0
D
V6
2.0
0
2.0
①请完成此实验设计:V5= , V6=。
②设计A号试管实验的目的是。
(4)、已知25℃时草酸的电离常数为K1=5.0×10-2 , K2=5.4×10-5。①写出H2C2O4与少量的KOH溶液反应的离子方程式:。
②已知25℃时CH3COOH的电离常数为K=1.75×10-5 , 则等浓度的草酸溶液和醋酸溶液中,pH较小的是。