广东省深圳市深实验2020-2021学年九年级上学期化学期末考试试卷
试卷更新日期:2021-01-26 类型:期末考试
一、单项选择题I;本大题共8小题,每小题1.5分,共12分。在每小题列出的四个选项中,只有一项最符合题意。
-
1. 下列有关说法正确的是( )A、工业上从液态空气中分离出氧气属于化学变化 B、用石灰浆(主要成分为氢氧化钙)刷墙壁,干燥后墙面变硬发生了化学变化 C、利用石油中各成分沸点不同,将石油分离得到汽油、煤油、柴油等属于化学变化 D、干冰升华是化学变化2. “见微知著”,研究微观是化学学习中重要的内容,有以下表述.其中正确的有( )
①氯气:Cl2
②由三个氧原子构成的臭氧分子:3O;
③右图粒子结构示意图表示的粒子:S2+
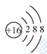
④两个铁离子: 2Fe2+;
⑤导电性最好的金属: Ag;
⑥+2价的镁元素:Mg+2
A、②④⑤ B、①⑤ C、①③⑤ D、①④⑥3. 下列有关实验现象的说法正确的是( )A、紫色石蕊溶液遇到醋酸变红色 B、硫在空气中燃烧,产生明亮的蓝紫色火焰,有刺激性气味的气体生成 C、红磷在空气中燃烧,产生白雾 D、铁丝在空气中剧烈燃烧,放出大量的热,火星四射,有黑色固体生成4. 碳酸乙烯酯(C3H4O3)可用作锂电池电解液。下列有关碳酸乙烯酯的说法正确的是( )A、碳酸乙烯酯是由3个碳原子,4个氢原子和3个氧原子构成的 B、其中C,H,O三种元素的质量比为3:4:3 C、其中碳元素的质量分数最大 D、碳酸乙烯酯的相对分子质量为885. 下列实验方案不能达到实验目的的是( )A、验证面粉粉尘能发生爆炸 B、验证分子在不断运动
B、验证分子在不断运动  C、探究物质燃烧的条件之一是需要可燃物
C、探究物质燃烧的条件之一是需要可燃物  D、探究石蜡中含有氢元素
D、探究石蜡中含有氢元素  6. 如图是元素周期表的一部分,下列说法错误的是( )
6. 如图是元素周期表的一部分,下列说法错误的是( ) A、三种元素的原子最外层电子数均小于4 B、C,N,O的原子序数依次增加 C、氧的相对原子质量为16.00 D、氮原子的核外电子数为77. 下列有关叙述,对应的化学方程式书写、所属基本反应类型都正确的是( )
A、三种元素的原子最外层电子数均小于4 B、C,N,O的原子序数依次增加 C、氧的相对原子质量为16.00 D、氮原子的核外电子数为77. 下列有关叙述,对应的化学方程式书写、所属基本反应类型都正确的是( )选项
叙述
化学方程式
基本反应类型
A
铝的自我保护
3Al+O2=Al3O2
化合反应
B
工业上制CO2
CaCO3 =CaO+CO2↑
分解反应
C
铁与盐酸混合
2Fe+6HCl=2FeCl3+3H2↑
置换反应
D
硫在空气中燃烧
S+O2 SO2
化合反应
A、A B、B C、C D、D8. 生活处处有化学,安全时刻记心中。下列做法不合理的是( )A、夜间发现家中石油液化气泄露,立即开灯查明泄露原因 B、用活性炭吸附冰箱中的异味 C、炒菜时,油锅不慎着火迅速用锅盖盖灭 D、高楼发生火灾时,用湿毛巾捂住口鼻在火场的浓烟中爬行逃生9. 如图是某化学反应的微观模型示意图。据此分析正确的是( )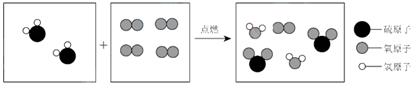 A、参加反应的两种物质的分子个数比1:2 B、生成物中有三种物质,既有单质又有化合物 C、化学变化过程中,分子的种类不一定发生改变 D、此反应不属于化合反应也不属于置换反应10. 下列各组转化中,不能一步实现的组合是( )A、H2O2 H2O H2 B、Fe Fe2O3 Fe C、KClO3 O2 Fe2O3 D、CH4 CO2 CO11. 除去下列物质中的少量杂质,能达到目的的是( )
A、参加反应的两种物质的分子个数比1:2 B、生成物中有三种物质,既有单质又有化合物 C、化学变化过程中,分子的种类不一定发生改变 D、此反应不属于化合反应也不属于置换反应10. 下列各组转化中,不能一步实现的组合是( )A、H2O2 H2O H2 B、Fe Fe2O3 Fe C、KClO3 O2 Fe2O3 D、CH4 CO2 CO11. 除去下列物质中的少量杂质,能达到目的的是( )选项
物质(括号内为杂质)
除去杂质的方法
A
镁粉(铜粉)
加足量稀硫酸、过滤、洗涤、烘干
B
除去FeSO4溶液中少量的CuSO4
加入足量铁粉,充分反应后过滤
C
除去KCl固体中的少量KClO3
加入少量的二氧化锰,加热
D
CaO (CaCO3)
加水溶解、过滤
A、A B、B C、C D、D12. 下列有关化学反应与反应时间对应的图形不正确的是( )A、一定量的镁条在空气中点燃生成氧化镁的质量 B、加热高锰酸钾制取氧气时剩余固体的质量
B、加热高锰酸钾制取氧气时剩余固体的质量  C、一定质量的木炭与过量氧气在密闭容器内加热使其充分反应
C、一定质量的木炭与过量氧气在密闭容器内加热使其充分反应  D、等质量的铁、锌分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系
D、等质量的铁、锌分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系 
二、非选择题(本大题共4小题,共30分)
-
13. 如图是实验室制取气体的一些装置,据图回答有关问题。(友情提示:以下所选装置均填装置序号)
 (1)、写出序号为②的仪器名称:②;(2)、写出化学实验室中选用装置C制取氧气的化学方程式 ;
(1)、写出序号为②的仪器名称:②;(2)、写出化学实验室中选用装置C制取氧气的化学方程式 ;为获得较干燥的氧气,可选用(填字母)作为收集装置。
(3)、试回答下列问题:实验室中制取二氧化碳可采用的发生装置是B,理由是。
其反应的化学方程式是。如果用A装置代替B,有什么优点。
14. 某小组同学在协助老师整理化学试剂时,发现-瓶标签残缺的无色液体(如图)(温馨提示:标签上的5%表示该混合物中主要成分所占的质量分数)。他们对此瓶无色液体是什么产生了兴趣,于是进行了如下探究: (1)、[大胆猜想]
(1)、[大胆猜想]猜想一:水;
猜想二:稀硫酸;
猜想三:过氧化氢溶液。
小组同学对标签又进行了仔细的观察、分析,他们一致认为猜想一不合理,理由是水是(填物质类别)。
[设计方案]
同学们结合所学知识设计出如下探究方案
实验方案
实验现象
方案一:向盛有少量镁条的试管中加入适量的该液体。
观察到试管中有产生。
涉及反应方程式为。
方案二:向盛有少量④(填化学式)的试管中加入适量的该液体,并将带火星的木条放在试管口。
观察到无气泡产生,带火星的木条不能复燃
(2)、[结论与解释]以上事实证明猜想是正确的。
[反思与评价]
为避免在今后的实验中出现标签残缺的情况,在倾倒液体时应注意。
15. 某化学兴趣小组的同学想从含有Al2(SO4)3、 CuSO4 的废液中回收金属铜,设计流程如图: (1)、操作①的名称为 , 需要使用玻璃棒,其作用是。(2)、Ⅰ中有关反应的化学方程式为 , 溶液由蓝色变为色。(3)、固体A的成分是、(填化学式)。(4)、Ⅱ中加入过量的稀硫酸的目的是。(5)、过程Ⅰ、Ⅱ中涉及反应的基本反应类型为。16. 许多电子元件中都使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
(1)、操作①的名称为 , 需要使用玻璃棒,其作用是。(2)、Ⅰ中有关反应的化学方程式为 , 溶液由蓝色变为色。(3)、固体A的成分是、(填化学式)。(4)、Ⅱ中加入过量的稀硫酸的目的是。(5)、过程Ⅰ、Ⅱ中涉及反应的基本反应类型为。16. 许多电子元件中都使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:第一次
第二次
第三次
第四次
加入稀硫酸的质量(g)
20
20
20
20
烧杯中剩余物的质量(g)
39.92
59.84
79.80
99.80
产生氢气的总质量(g)
0.08
0.16
0.20
m
(1)、兴趣小组同学发现:电子元件中的黄铜较难研磨成粉末,原因之一是黄铜合金的硬度比组成它的纯金属硬度(填“大”或“小”)。(2)、黄铜合金中的铜不能与稀硫酸发生反应,原因是。(3)、兴趣小组同学发现:生成氢气的质量既可通过实验测定获得,也可通过计算获得。计算方法是:所加稀硫酸总质量加上黄铜质量,最后减去烧杯中剩余物质的质量,计算的依据是定律。(4)、黄铜粉末完全反应生成氢气的总质量,即m值为g。(5)、该黄铜中铜的质量分数为多少? (写出计算过程)