浙教版科学 八年级下 第三章 第3节 化学方程式
试卷更新日期:2021-01-20 类型:同步测试
一、单选题
-
1. 在化学反应A+B=C+D中,若有5克的A与10克的B恰好完全反应,生成1克的C和一定质量的D,,小明做实验前发现容器中只有5克B,则最多生成的D的质量为( )A、5克 B、7克 C、13克 D、8克2. 铜能与硝酸反应,但不产生H2 . 根据反应方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2X↑+4H2O,推测X的化学式是( )A、N2O3 B、NO2 C、NO D、N2O3. 将苯(C6H6)和氧气置于一个完全密闭的容器中引燃,反应生成二氧化碳、水和 X。已知反应前后各物质的质量如下:则下列有关说法正确的是( )
物质
苯
氧气
二氧化碳
水
X
反应前的质量(g)
3.9
9.6
0
0
0
反应后的质量(g)
0
0
6.6
2.7
m
A、m 等于 4.0 B、X 由碳、氧两种元素组成 C、X 由碳、氢两种元素组成 D、生成物中二氧化碳和水的分子个数比为 3∶14. A、B、C三种物质各15克,它们化合时只能生成30克新物质D。若增加10克A,则反应停止后,原反应物中只剩余C。根据上述条件推断下列说法中正确的是( )A、第一次反应停止后,B剩余9克 B、第二次反应后,D的质量为50克 C、反应中A和B的质量比是3:2 D、反应中A和C的质量比是5:35. 在反应 2A+B═3C+D 中,A 和 B 的相对分子质量之比为 5∶1,已知 20gA 与一定量 B 恰好完全反应,生成 5gD,则在此反应中 B 和C 的质量比为( )A、4∶19 B、2∶17 C、1∶3 D、3∶56. 山茶油是一种绿色保健食品,其主要成分是柠檬醛。现从山茶油中提取7.6g柠檬醛,使其在氧气中完全燃烧,生成22g二氧化碳和7.2g水,则柠檬醛中( )A、只含有碳、氢元素 B、一定含有碳、氢、氧元素 C、一定含有碳、氢元素,可能含有氧元素 D、含有的元素无法确定7. 用I2O5可以测定空气受CO污染的程度,发生反应的化学方程式为:I2O5+5CO=I2+5CO2 , 根据生成的CO2的多少,可以判断CO的含量,关于这个反应,下列说法中正确的是 ( )A、参加反应的I2O5的质量等于生成的I2的质量 B、参加反应的各物质中的氧原子总数等于生成的CO2中的氧原子数 C、反应物所含元素种类与生成物所含元素种类不同 D、参加反应的I2O5和CO的质量比等于生成的I2和CO2的质量比8. 在化学反应A2+BC=B+A2C中,反应物BC与生成物B的质量关系如图所示。将2gA2与80gBC恰好完全反应,则生成A2C的质量为( ) A、64g B、80g C、18g D、9g9. 关于化学方程式 2H2+O2 2H2O 表示的意义,下列说法不正确的是( )A、反应需要在点燃条件下进行 B、氢气和氧气参加反应,生成了水 C、参加反应的氢气、氧气及生成的水的分子个数比为 2:1:2 D、2 份质量的氢气和 1 份质量的氧气恰好完全反应生成 2 份质量的水10. 小乐将蜡烛燃烧后的蜡油收集起来,发现质量变小。关于蜡烛的燃烧,下列说法正确的是( )A、蜡烛燃烧生成了新物质,故此过程只有化学变化 B、蜡烛燃烧产生的气体能使燃着的木条熄灭,说明蜡烛燃烧生成了二氧化碳 C、蜡烛减少的质量等于生成二氧化碳和水等物质的质量 D、燃烧后蜡油的质量小于蜡烛的质量,体现了化学反应前后质量守恒11. 质X在4.8g氧气中恰好完全燃烧,反应方程式为X+3O2点燃RO2+2SO2 , 测得RO2和SO2的质量分别为2.2g和6.4g,下列判断中正确的是( )A、参加反应的X的质量为4.3g B、X的相对分子质量为76 C、X中含有R元素、S元素和O元素 D、产物为气态时都是空气污染物12. 在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中错误的是( )。
A、64g B、80g C、18g D、9g9. 关于化学方程式 2H2+O2 2H2O 表示的意义,下列说法不正确的是( )A、反应需要在点燃条件下进行 B、氢气和氧气参加反应,生成了水 C、参加反应的氢气、氧气及生成的水的分子个数比为 2:1:2 D、2 份质量的氢气和 1 份质量的氧气恰好完全反应生成 2 份质量的水10. 小乐将蜡烛燃烧后的蜡油收集起来,发现质量变小。关于蜡烛的燃烧,下列说法正确的是( )A、蜡烛燃烧生成了新物质,故此过程只有化学变化 B、蜡烛燃烧产生的气体能使燃着的木条熄灭,说明蜡烛燃烧生成了二氧化碳 C、蜡烛减少的质量等于生成二氧化碳和水等物质的质量 D、燃烧后蜡油的质量小于蜡烛的质量,体现了化学反应前后质量守恒11. 质X在4.8g氧气中恰好完全燃烧,反应方程式为X+3O2点燃RO2+2SO2 , 测得RO2和SO2的质量分别为2.2g和6.4g,下列判断中正确的是( )A、参加反应的X的质量为4.3g B、X的相对分子质量为76 C、X中含有R元素、S元素和O元素 D、产物为气态时都是空气污染物12. 在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中错误的是( )。 A、根据质量守恒定律,X的值应为0 B、反应后的生成物是二氧化碳和水 C、氧元素的化合价在反应前后发生改变 D、物质W只含碳、氢两种元素
A、根据质量守恒定律,X的值应为0 B、反应后的生成物是二氧化碳和水 C、氧元素的化合价在反应前后发生改变 D、物质W只含碳、氢两种元素二、填空题
-
13. 益阳市桃江县硫铁矿厂开采的黄铁矿(主要成分是FeS2),是生产H2SO4的重要原料。利用黄铁矿生产H2SO4的第一步反应为:4FeS2+11O2═2Fe2O3+8X。所得产物Fe2O3是冶炼铁的重要原料。回答下列问题:(1)、已知FeS2中Fe的化合价为+2,则S的化合价为。(2)、X的化学式是。14. 取氯酸钾和二氧化锰的混合物15.50克,放入一个大试管中加热,完全反应后冷却到反应前的温度,称得残余固体物质的质量为10.70克。求:(1)、生成氧气的质量克?(2)、原混合物中二氧化锰克?15. 在反应A+B=C+2D中,已知2.9gA跟4.9gB完全反应,生成6.0gC,又知道D的式量(相对分子量)为18,则A的相对分子质量为。16. 在 2A+6B=2C+3D 反应中,54克A在400克B中完全反应,生成264克C和6克D,则有 克B参加反应,反应中A 和D 的相对分子质量比为。17. 将6.0g某物质在空气中完全燃烧,生成17.6g二氧化碳和10.8g水,则该物质的组成元素是。18. 在一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,请回答:
物质
甲
乙
丙
丁
反应前质量(g)
18
20
10
30
反应后质量(g)
2
20
50
X
(1)、反应后丁物质的质量X=g;(2)、该反应中甲和丙两种物质变化的质量比为;(3)、该反应属于反应(填“化合”或“分解”)。三、实验探究题
-
19. 利用加热高锰酸钾的方法,验证化学反应中质量守恒定律。如图,小科将适量高锰酸钾装入试管,塞入一团棉花并测出试管、棉花与药品的总质量为m。加热使之充分反应后,测得量筒中气体体积为V,再次测得反应装置与物质总质量为m2,已知常温常压下氧气密度为p。据此请回答:
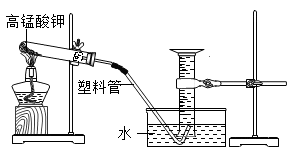 (1)、实验中用量筒收集气体的好处是。(2)、实验中,试管口内壁附着紫红色小液滴,请解释产生该现象的原因。(3)、根据实验数据计算发现: ,与质量守恒定律不符。造成这一实验结果的原因分析正确的是A、试管中高锰酸钾没有完全分解 B、导管口连续均匀冒气泡时才收集气体 C、未调节量筒内外液面相平就读数 D、停止加热时,先将导管移出水面,再熄灭酒精灯20. 甲乙两位同学为了验证质量守恒定律,分别设计了如图1、图2的实验装置,进行实验。
(1)、实验中用量筒收集气体的好处是。(2)、实验中,试管口内壁附着紫红色小液滴,请解释产生该现象的原因。(3)、根据实验数据计算发现: ,与质量守恒定律不符。造成这一实验结果的原因分析正确的是A、试管中高锰酸钾没有完全分解 B、导管口连续均匀冒气泡时才收集气体 C、未调节量筒内外液面相平就读数 D、停止加热时,先将导管移出水面,再熄灭酒精灯20. 甲乙两位同学为了验证质量守恒定律,分别设计了如图1、图2的实验装置,进行实验。 (1)、甲同学:①按图1连接好装置,检查装置气密性的方法是;
(1)、甲同学:①按图1连接好装置,检查装置气密性的方法是;②向锥形瓶中加入石灰石粉末,注射器吸入少量稀盐酸;
③将装置放在天平左盘,通过加减砝码和移动游码使天平平衡;
④快速下推注射器活塞,使反应发生,此时观察到的现象为;
⑤反应结束后,再进行第2次称量,发现质量没有发生变化,于是证明质量是守恒。
(2)、乙同学:按图2装置进行实验,称量反应物至天平平衡,然后将气球中的粉末倒入锥形瓶中充分反应,再次称量发现天平的指针向右倾斜,得出质量并不守恒。反应后天平不平衡的原因是。21. 小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置如图 (1)、根据实验目的,小李必须测量的数据是A、锥形瓶质量 B、气球质量 C、反应前整个反应装置(包括里边的物质)质量 D、反应后整个反应装置(包括里边的物质)质量(2)、将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中.反应结束后,气球鼓起,
(1)、根据实验目的,小李必须测量的数据是A、锥形瓶质量 B、气球质量 C、反应前整个反应装置(包括里边的物质)质量 D、反应后整个反应装置(包括里边的物质)质量(2)、将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中.反应结束后,气球鼓起,天平向右倾斜。请你帮他分析原因
(3)、小李和同学们针对问题改进了装置,利用改进后的最佳装置再次探究,发现天平保持平衡,进一步分析发现,反应体系和未参加反应的物质的质量在反应前后保持不变,最终得出结论:等于反应后生成的各物质的质量总和。(4)、应用:某固体物质受热分解,生成氧化铜(CuO)、水、二氧化碳三种物质,则该固体物质一定由种元素组成。22. 在“质量守恒定律”的课堂教学中,老师引导同学们进行“化学反应中,反应物与生成物的质量关系”的实验探究。同学们按如图所示的实验装置,选用药品进行了规范的操作、准确的称量和细致的观察。
 (1)、甲乙两实验中发生了相同的化学反应(2HCl+Na2CO3=2NaCl+H2O+CO2↑),但化学反应结束后称量,发现甲实验中天平指针偏右,而乙实验中天平仍然平衡,分析其原因是。(2)、丙组同学完成镁带燃烧实验后发现镁带质量增加了,你认为镁带燃烧符合“质量守恒定律”吗?。(选填“符合”或“不符合”)
(1)、甲乙两实验中发生了相同的化学反应(2HCl+Na2CO3=2NaCl+H2O+CO2↑),但化学反应结束后称量,发现甲实验中天平指针偏右,而乙实验中天平仍然平衡,分析其原因是。(2)、丙组同学完成镁带燃烧实验后发现镁带质量增加了,你认为镁带燃烧符合“质量守恒定律”吗?。(选填“符合”或“不符合”)四、解答题
-
23. 发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染。(1)、反应的化学方程式为2N2H4+N2O4 +4H2O,请在横线上填写化学式以完成该化学方程式。(2)、请计算9.6 kgN2H4完全燃烧需要助燃物N2O4的质量。24. 某学习小组用KClO3和MnO2的混合物加热制取O2 , 收集到4.8gO2后停止加热,称得剩余固体的质量为28.0g,继续加热至不再产生O2 , 最终剩余固体质量为23.2g,试计算(不考虑O2的损耗);(1)、两次生成O2的总质量为g.(2)、理论上可回收到MnO2的质量(写出计算过程)