浙江省湖州市吴兴区2020-2021学年九年级上学期科学期中考试试卷(到第3章第3节)
试卷更新日期:2021-01-19 类型:期中考试
一、选择题(本大题共16题,每小题3分,共48分,每小题只有一个选项符合题意)
-
1. “一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐可能是( )A、熟石灰 B、碳酸钾 C、乙醇 D、烧碱2. 下列各组物质的名称、俗称(主要成分)和化学式,表示同一种物质的是( )A、氧化钙、熟石灰、CaO B、汞、水银、Ag C、氢氧化钠、烧碱、NaOH D、氢氧化钙、石灰石、Ca(OH)23. 工业冶炼金属钛的反应原理是TiCl4+2Mg Ti+2MgCl2 , 该反应类型属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应4. 下列生活经验没有应用酸碱反应原理的是( )A、用熟石灰改良酸性土壤 B、用氢氧化钠溶液洗涤石油产品中的残留硫酸 C、用氢氧化铝治疗胃酸过多 D、用生石灰作干燥剂5. 生铁和足量的稀盐酸充分反应后会留有残渣,残渣的主要成分是( )A、氯化亚铁 B、碳 C、氯化铁 D、铁6. 世界每年因锈蚀而损失的金属数量巨大,防止金属锈蚀已成为科学研究中的重大问题。下列有关金属锈蚀与保护措施中不正确的是( )A、在铁表面刷油漆可以防止铁锈蚀 B、及时擦干被雨水淋湿的自行车可防止生锈 C、铝的抗锈蚀性比铁强,是因为铝的活动性比铁弱 D、铁容易与氧气、水蒸气等发生反应,因此可以做干燥剂7. 下面是一些物质粒子的示意图,“
 ”、“
”、“ ”、“
”、“  ”分别代表不同种类元素的原子,其中可能属于氧化物的是( ) A、
”分别代表不同种类元素的原子,其中可能属于氧化物的是( ) A、 B、
B、 C、
C、 D、
D、 8. 在pH=1的无色溶液中能大量共存的离子组是( )A、NH4+、Mg2+、Cl﹣、Zn2+ B、K+、Ba2+、OH﹣、NO3﹣ C、Mg2+、Cu2+、Cl﹣、SO42﹣ D、Na+、Cl﹣、Ba2+、SO42﹣9. 氢气和一氧化碳还原氧化铜的实验装置如图所示,下列有关说法错误的是( )
8. 在pH=1的无色溶液中能大量共存的离子组是( )A、NH4+、Mg2+、Cl﹣、Zn2+ B、K+、Ba2+、OH﹣、NO3﹣ C、Mg2+、Cu2+、Cl﹣、SO42﹣ D、Na+、Cl﹣、Ba2+、SO42﹣9. 氢气和一氧化碳还原氧化铜的实验装置如图所示,下列有关说法错误的是( ) A、实验时都应该先通入气体后加热,防止发生爆炸 B、两者都可以通过观察固体颜色的变化判断反应是否发生 C、甲中试管口略向下倾斜,乙中玻璃管保持水平,是因为两种气体的密度不同 D、甲中无尾气处理装置而乙中有,是因为一氧化碳有毒而氢气无毒10. 下列各组变化中,每一步转化在一定条件下均能一步实现的是( )A、NaCl→Na2CO3→NaOH B、Fe→Fe2O3→Fe(OH)3 C、BaSO4→BaCl2 →BaCO3 D、CuO→CuCl2→ZnCl211. 金属Ni、Zn分别放入其他三种金属盐X、Y、Z的溶液中,置换反应的结果,有无金属析出的情况如表:它们的金属活动性递减的顺序是( )
A、实验时都应该先通入气体后加热,防止发生爆炸 B、两者都可以通过观察固体颜色的变化判断反应是否发生 C、甲中试管口略向下倾斜,乙中玻璃管保持水平,是因为两种气体的密度不同 D、甲中无尾气处理装置而乙中有,是因为一氧化碳有毒而氢气无毒10. 下列各组变化中,每一步转化在一定条件下均能一步实现的是( )A、NaCl→Na2CO3→NaOH B、Fe→Fe2O3→Fe(OH)3 C、BaSO4→BaCl2 →BaCO3 D、CuO→CuCl2→ZnCl211. 金属Ni、Zn分别放入其他三种金属盐X、Y、Z的溶液中,置换反应的结果,有无金属析出的情况如表:它们的金属活动性递减的顺序是( )X盐
Y盐
Z盐
Ni
无
无
有
Zn
无
有
有
A、X、Zn、Ni、Y、Z B、X、Y、Ni、Zn、Z C、Z、Zn、Y、Ni、X D、X、Zn、Y、Ni、Z12. 等质量的镁和锌分别放置在两只烧杯中,向其中分别逐滴加入质量分数相等的稀硫酸到过量,下图关系图中正确的是( )A、
B、
B、
C、
C、
D、
D、
13. 下列除去杂质的方法能达到目的是( )
13. 下列除去杂质的方法能达到目的是( )选项
物质
杂质
除杂方法
A
CO2
CO
将气体点燃
B
N2
O2
通过炽热的木炭
C
CuO
Cu
加足量稀盐酸、过滤、洗涤沉淀物、干燥固体
D
KCl
K2CO3
加足量稀盐酸、过滤、蒸发滤液、结晶
A、A B、B C、C D、D14. 下列现象中,利用了自然界的机械能资源的是( )A、村庄里的沼气池 B、齐跃山风力发电 C、新疆地热发电 D、硅光电池板供电15. 跳伞运动员在空中打开降落伞后,先后经历减速下降和匀速下落两个过程,下列说法正确的是( )A、减速下降过程中,势能增大,动能减小,机械能不变 B、减速下降过程中,势能减小,动能增大,机械能不变 C、匀速下落过程中,势能减小,动能不变,机械能减小 D、匀速下落过程中,势能增大,动能不变,机械能增大16. 如图所示,小球从粗糙的斜坡a点由静止滑下,依次经过b、c、d最后恰好停在e点,其中b和d点在同一水平高度,则下列说法正确的是( ) A、小球从a点到c点过程中,重力势能转化为动能,小球的机械能守恒 B、小球在c点的机械能最大 C、小球在b点和d点动能和重力势能都相等 D、小球在d点的机械能比b点机械能小
A、小球从a点到c点过程中,重力势能转化为动能,小球的机械能守恒 B、小球在c点的机械能最大 C、小球在b点和d点动能和重力势能都相等 D、小球在d点的机械能比b点机械能小二、填空题(本大题共7小题,每空2分,共32分)
-
17. 冬天市场上有一种“热宝”出售,它是一个装有化学药品的小袋。已知小袋中装有铁粉、碳粉和少量氯化钠。(1)、取小袋内的物质,加入稀盐酸中,看到的现象是。(2)、取小袋内的物质,加入到一定量的CuSO4溶液中,发生反应的化学方程式为。18. 小敏对妈妈说:“你说菠菜中富含铁,为什么我用磁铁无法把菠菜吸起来呢?”(1)、小敏认为的“铁”是指(选填“铁元素”或“铁单质”)。(2)、写出利用CO将铁矿石(主要成分是Fe2O3)中的铁元素转变成铁单质的化学反应方程式 , 此反应利用了CO的性。19. 人类社会的发展离不开金属。(1)、金属镁是制作烟花的主要成分,镁条在空气中燃烧时实验现象为;(2)、向废液(溶质是AgNO3、Cu(NO3)2)中加入一定量的金属锌,反应结束后,发现溶液仍然是蓝色。据此推断,反应后溶液中一定含有的阳离子是。20. 第七届世界军人运动会于2019年10月18日至27日在中国武汉举行,本届军运会上,“水与火相交融”的主火炬塔点燃方式让人印象深刻。据介绍火炬燃气是天然气(主要成分是甲烷CH4),通过水把天然气托到水柱的上方进行燃烧。(1)、火炬的材质为铝合金,属于(填“金属”“非金属”或“合成”)材料。(2)、请写出甲烷燃烧的化学方程式:。(3)、根据上述现象请写出甲烷两点性质:。(4)、请从环保的角度说明甲烷做燃料的理由:。21. 如图所示的无人驾驶消毒车,在马路上匀速行驶并喷洒消毒剂,在此行驶过程中消毒车动能(选填“增大”“减小”或“不变”,下同),消毒车重力势能。
 22. 蹦极是深受欢迎的户外运动,如图所示,不考虑空气阻力,关于蹦极者在下降过程中的能量分析,下列说法中正确的是(可多选)
22. 蹦极是深受欢迎的户外运动,如图所示,不考虑空气阻力,关于蹦极者在下降过程中的能量分析,下列说法中正确的是(可多选)

①弹性绳绷直前,重力势能减小,动能变大 ②弹性绳绷直瞬间动能最大
③下降到最低点动能最小 ④下降到最低点弹性势能最大
23. 氢氧化钠溶液和二氧化碳反应没有明显现象,为验证CO2与NaOH能够发生反应,某同学按如图实验装置进行实验。
 (1)、药品滴加顺序往往会影响实验结果,该实验加入试剂的正确顺序应该是 。A、先加入盐酸,再加入氢氧化钠溶液 B、先加入氢氧化钠溶液,再加入盐酸(2)、实验过程中气球的变化情况是。
(1)、药品滴加顺序往往会影响实验结果,该实验加入试剂的正确顺序应该是 。A、先加入盐酸,再加入氢氧化钠溶液 B、先加入氢氧化钠溶液,再加入盐酸(2)、实验过程中气球的变化情况是。三、实验探究题(本大题共5小题,除24题第三空3分外,每空2分,共37分)
-
24. 甜叶菊苷是一种新型甜味剂,其甜度为蔗糖的250~450倍,某实验小组欲探究甜叶菊苷的元素组成,进行了如图1的操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。
 (1)、小晴认为该实验设计不严谨,原因是。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。(2)、为了进步确定其元素组成,小晴利用如图2装置进行实验。
(1)、小晴认为该实验设计不严谨,原因是。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。(2)、为了进步确定其元素组成,小晴利用如图2装置进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)
①实验中B装置的作用是什么?
②4.02g甜叶菊苷在C装置中充分反应后,D装置增重2.7g,E装置增重8.36g。为了确定甜叶菊苷中是否含有氧元素,下一步应该如何处理这些数据?请你写出计算过程和判断结果。
25. 金属与酸反应属于放热反应,现探究酸的质量分数对反应速率的影响,实验室提供如图甲器材和颗粒均匀的锌粒、铁片、2%稀盐酸、4%稀盐酸、6%稀盐酸、碎冰、水等药品。(1)、实验过程如下:①检查装置气密性:用止水夹夹住a处橡皮管,往漏斗中加水,液面 , 说明装置的气密性好;
②装药品:在烧杯中加入碎冰和一定量的水。在试管中装入锌粒,把试管放入烧杯内的冰中。之后的重复实验也都在冰水混合物中进行,这样做的目的是。而后用铁架台把试管定,再连接好其他装置;
③开始反应和测量:打开止水夹,往漏斗中倒入一定量的2%稀盐酸,量筒中的水量不再变化时,记录水的量,这个量就是反应得到的气体的量。
④取等量的锌粒与4%和6%稀盐酸进行反应,重复上述实验;
⑤取铁片代替锌粒进行反应,重复上述实验。

 (2)、实验结论:其他条件都相同时,酸的质量分数越大,反应越快。图乙是某资料中铁与4%稀硫酸在恒温条件下,生成氢气体积随时间变化的图象。请你画出铁与6%稀硫酸在恒温条件下,生成氢气体积随时间变化的图象。(在答题纸图乙上用实线画出)26. 化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:
(2)、实验结论:其他条件都相同时,酸的质量分数越大,反应越快。图乙是某资料中铁与4%稀硫酸在恒温条件下,生成氢气体积随时间变化的图象。请你画出铁与6%稀硫酸在恒温条件下,生成氢气体积随时间变化的图象。(在答题纸图乙上用实线画出)26. 化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:【查找资料】
⑴氯化钙溶液显中性。
⑵玻璃中含有二氧化硅,试剂瓶瓶身经抛光处理,不易反应,而瓶口和玻璃塞上的磨砂将二氧化硅裸露出来:二氧化硅与氢氧化钠溶液反应生成硅酸钠(Na2SiO3)和水。
⑶硅酸钠是一种白色固体,有很强的粘合性,可溶于水,水溶液呈碱性:硅酸钠溶液能与稀盐酸、氯化钙溶液反应,反应的化学方程式如下:Na2SiO3+2HCl=2NaCl+H2SiO3↓(白色)、Na2SiO3+CaCl2=2NaCl+CaSiO3↓(白色)
【提出问题】瓶口白色固体的成分是什么?
【作出猜想】猜想一:硅酸钠
猜想二:硅酸钠和碳酸钠
猜想三:硅酸钠、碳酸钠和氢氧化钠。
【实验探究】取一定量白色固体溶于适量水中形成样品溶液,同学们进行如下实验:
(1)、取少量样品溶液于试管中,向其中加入过量的稀盐酸,观察到有白色沉淀生成,且有气泡冒出,大家一致认为猜想一不正确,理由是。(2)、为了进一步验证哪种猜想是正确的,同学们继续进行实验,请你帮助他们设计实验并完成实验报告。实验步骤
实验现象
实验结论
I.取少量样品溶液于试管中,
向试管中加入过量氯化钙溶液,静置。
生成白色沉淀
猜想三正确
Ⅱ.。
。
(3)、【反思交流】在实验步骤I中加入过量氯化钙溶液的目的是。氢氧化钠溶液必须密封保存,且试剂瓶只能用橡胶塞。27. 学习科学知识和技能,可以帮助我们鉴别和检验物质(1)、在实验室鉴别白酒与白醋,最简单的方法是。(2)、现有两瓶失去标签的无色溶液,其中一瓶是氢氧化钙溶液,一瓶是稀盐酸。为了鉴别它们,同学们设计了如下实验方案:先给两瓶溶液贴上标签A、B,然后分别取样进行实验。请将横线部分填写完整:加入的试剂
现象
结论
方案1
二氧化碳
A中出现白色浑浊,B中无明显现象。
A是溶液,
B是另一种溶液。
方案2
碳酸钠溶液
。
方案3
试剂X
……
(3)、【方法感悟】在鉴别物质时,要先分析物质的性质,然后选择恰当的试剂,必须产生不同现象才能达到鉴别物质的目的。【拓展应用】完成方案3,请从下列提供的试剂中选出所有能鉴别出这两种物质的试剂X:(填序号)
①酚酞溶液 ②pH试纸 ③镁 ④氧化铜 ⑤稀硝酸 ⑥氢氧化铜 ⑦氯化镁溶液 ⑧硝酸钡溶液
28. 如图,用小球和木块来做探究“动能大小与哪些因素有关”的实验。 (1)、实验中是通过比较木块移动的距离来比较动能大小。以下实验中也用到了相同的科学方法的是
(1)、实验中是通过比较木块移动的距离来比较动能大小。以下实验中也用到了相同的科学方法的是。
A、探究种子萌发的条件 B、黄豆和芝麻演示分子之间有空隙 C、探究影响电磁铁磁性强弱的因素 D、磁感线研究磁场问题 E、研究电路时用电路图来表示电路连接.(2)、本实验研究的动能是指 。A、小球在斜面上释放时的动能 B、小球撞击木块时的动能 C、撞击后木块的动能 D、撞击后小球的动能(3)、分析比较A、B两次实验,可得出结论:;(4)、本实验装置的水平面如果绝对光滑,还能得出结论吗?回答并说明你的理由。四、解答题(29题4分、30题7分、31题6分、32题6分、33题8分、34题6分、35题6分,共43分)
-
29. 某司机驾驶一辆满载的货车,行至高速公路一处连续下坡路段时,因长时间刹车使汽车刹车片发热,导致刹车失灵。危急之下,他将汽车驶入右侧紧急避险车道。如图所示,避险车道是一个上坡道,且路面铺了一层厚厚的砂石,汽车迅速减速,避免了重大事故发生。请从能量转化的角度解释:汽车驶入避险车道后能迅速减速的原因。
 30. 酒精,学名乙醇,化学式CH3CH2OH,在常温常压下是一种易燃、易挥发的无色透明液体,挥发后的气态酒精与空气可形成爆炸性混合物,遇明火、高热会引起爆炸燃烧。在新冠肺炎防疫战中,医用酒精在皮肤消毒和医疗器械消毒上发挥了重要作用。请结合资料,回答下列问题:(1)、上述关于酒精的描述中,属于化学性质的是:。(2)、酒精分子中C、H、O元素的质量比为:。(3)、计算138g乙醇完全燃烧产生二氧化碳的质量。31. 有一包白色粉末,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究其组成,进行如图所示实验:
30. 酒精,学名乙醇,化学式CH3CH2OH,在常温常压下是一种易燃、易挥发的无色透明液体,挥发后的气态酒精与空气可形成爆炸性混合物,遇明火、高热会引起爆炸燃烧。在新冠肺炎防疫战中,医用酒精在皮肤消毒和医疗器械消毒上发挥了重要作用。请结合资料,回答下列问题:(1)、上述关于酒精的描述中,属于化学性质的是:。(2)、酒精分子中C、H、O元素的质量比为:。(3)、计算138g乙醇完全燃烧产生二氧化碳的质量。31. 有一包白色粉末,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究其组成,进行如图所示实验: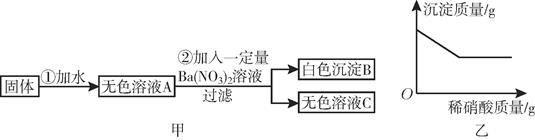 (1)、取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随滴加稀硝酸质量的变化如图乙所示。则可确定原固体中一定含有。(2)、取无色溶液C向其中通入二氧化碳气体,产生白色沉淀。则无色溶液C中除NaNO3外,其余溶质还有。(3)、为进一步确定原固体中可能含有的物质是否存在,应采用的操作步骤是 , 通过观察现象即可确定。32. 久置的铜制品表面会有绿色的铜锈,小乐对铜锈展开了如下研究,回答问题。(1)、小乐查阅资料发现,铜锈的成分复杂,主要成分有碱式碳酸铜和碱式氯化铜。考古学家从保护铜制品的角度出发,将铜锈分为无害锈和有害锈。碱式碳酸铜和碱式氯化铜分别属于无害锈和有害锈,其结构如图1所示:
(1)、取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中的沉淀质量随滴加稀硝酸质量的变化如图乙所示。则可确定原固体中一定含有。(2)、取无色溶液C向其中通入二氧化碳气体,产生白色沉淀。则无色溶液C中除NaNO3外,其余溶质还有。(3)、为进一步确定原固体中可能含有的物质是否存在,应采用的操作步骤是 , 通过观察现象即可确定。32. 久置的铜制品表面会有绿色的铜锈,小乐对铜锈展开了如下研究,回答问题。(1)、小乐查阅资料发现,铜锈的成分复杂,主要成分有碱式碳酸铜和碱式氯化铜。考古学家从保护铜制品的角度出发,将铜锈分为无害锈和有害锈。碱式碳酸铜和碱式氯化铜分别属于无害锈和有害锈,其结构如图1所示:
请解释碱式碳酸铜属于无害锈的原因。
(2)、小乐取44.4克纯净的碱式碳酸铜样品,利用图2示装置(夹持仪器省略)验证其化学式为Cu2(OH)2CO3。(已知:碱式碳酸铜受热分解可得到氧化铜、水和二氧化碳;碱石灰是氧化钙和氢氧化钠的固体混合物)
①装置丙的作用是。
②实验前、后均需对装置甲、乙、丙进行称重;当装置甲中固体质量不再减少,对装置甲、乙、丙进行再次称重前,需打开活塞再次通入足量的N2 , 其目的是。
33. 安多夫是一种“嫩肉粉”,是食品添加剂的一种。安多夫的成分是碳酸氢钠和氯化钠。(其中碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑)。某科学兴趣小组为了测定某种安多夫中碳酸氢钠的含量做了以下实验:取10克安多夫粉末,分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
 (1)、实验后,兴趣小组又往烧杯中加入少量粉末,观察到 , 说明上述实验结束时稀盐酸过量。(2)、计算这种安多夫中碳酸氢钠的质量。(3)、计算上述反应结束后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)34. 现有10g锌、8g氧化铜和足量的稀硫酸,小明想用这些锌和氧化铜为原料来制取铜单质,他采用了如下所示的流程图和实验装置(如图1):
(1)、实验后,兴趣小组又往烧杯中加入少量粉末,观察到 , 说明上述实验结束时稀盐酸过量。(2)、计算这种安多夫中碳酸氢钠的质量。(3)、计算上述反应结束后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)34. 现有10g锌、8g氧化铜和足量的稀硫酸,小明想用这些锌和氧化铜为原料来制取铜单质,他采用了如下所示的流程图和实验装置(如图1):Zn H2 Cu
 (1)、实验时,为了能够持续地小流量地产生氢气,图中的仪器应该如何进行更换?。(2)、若8克氧化铜完全反应,试计算能生成多少克单质铜?(3)、按照规范操作要求完成实验后,小明发现10g锌全部用完后,试管中仍然存在少量黑色固体。但他根据化学方程式计算得出:使8g氧化铜完全反应,只需要消耗6.5g锌粒制取的氢气。请你帮助解释原因:。35. 5G通讯需要大量光纤连接各种基站,在光纤的表面涂布Cu-Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu-Al合金层中铝的质量分数,小乐进行了相关实验,测得实验数据如表所示,则:
(1)、实验时,为了能够持续地小流量地产生氢气,图中的仪器应该如何进行更换?。(2)、若8克氧化铜完全反应,试计算能生成多少克单质铜?(3)、按照规范操作要求完成实验后,小明发现10g锌全部用完后,试管中仍然存在少量黑色固体。但他根据化学方程式计算得出:使8g氧化铜完全反应,只需要消耗6.5g锌粒制取的氢气。请你帮助解释原因:。35. 5G通讯需要大量光纤连接各种基站,在光纤的表面涂布Cu-Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu-Al合金层中铝的质量分数,小乐进行了相关实验,测得实验数据如表所示,则:甲
乙
丙
加入Cu-Al合金层样品粉末的质量(g)
10
10
20
加入稀硫酸的质量(g)
100
50
50
烧杯中剩余物的质量(g)
109
59
69
(1)、实验中Cu-Al合金层样品粉末与稀硫酸恰好完全反应的实验是 (选填“甲”“乙”或“丙”);(2)、该Cu-Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)