江苏省南京市秦淮区2020-2021学年九年级上学期化学期中考试试卷
试卷更新日期:2021-01-18 类型:期中考试
一、单选题
-
1. 物质的下列性质中,属于化学性质的是( )A、颜色 B、密度 C、可燃性 D、熔点2. 下列实验操作正确的是( )A、
 点燃酒精灯
B、
点燃酒精灯
B、 读取液体的体积
C、
读取液体的体积
C、 过滤
D、
过滤
D、 倾倒液体
3. 下列物质由离子构成的是( )A、氨气 B、氮气 C、氯化钠 D、金刚石4. 臭氧层是地球的保护伞,臭氧(O3)属于( )A、纯净物 B、混合物 C、氧气 D、稀有气体5. 下列科学家和相关研究对应正确的是( )
倾倒液体
3. 下列物质由离子构成的是( )A、氨气 B、氮气 C、氯化钠 D、金刚石4. 臭氧层是地球的保护伞,臭氧(O3)属于( )A、纯净物 B、混合物 C、氧气 D、稀有气体5. 下列科学家和相关研究对应正确的是( )选项
A
B
C
D
科学家
拉瓦锡
张青莲
道尔顿
门捷列夫
相关研究
发现了元素周期律并编制出元素周期表
主持测定了铟、铱、锑、铕、铈、铒、锗、锌、镝几种元素相对原子质量的新值
用精确的定量实验研究了氧化汞的分解和合成反应中各物质质量之间的变化关系
在《化学哲学新体系》一书中论述了原子论的观点
A、A B、B C、C D、D6. 下列做法有利于保护水资源的是( )A、生活中节约用水 B、工业废水任意排放 C、大量开采使用地下水 D、大量使用化肥和农药7. 下列化学用语中关于数字“2”的意义,说法正确的是( )A、O2表示2个氧原子 B、2O表示2个氧元素 C、O2﹣表示氧元素的化合价为﹣2价 D、2O2表示2个氧分子8. 下列关于空气各成分的说法中,错误的是( )A、氮气的化学性质不活泼,常用作保护气 B、炼钢、气焊和航空航天等都要用到氧气 C、稀有气体约占空气体积的0.03% D、植物的光合作用需要二氧化碳9. 下列关于催化剂的说法中,正确的是( )A、催化剂一定能加快化学反应速率 B、反应前后催化剂的质量和性质不变 C、一种催化剂只能催化一个化学反应 D、一个化学反应可能存在多种催化剂10. 如图所示检查装置的气密性,用手紧握试管,水中的导管口有气泡冒出的微观原因是() A、分子间隔变大 B、分子体积变大 C、分子质量变大 D、分子个数变多11. 相同质量的钠、镁、铝、铁中,含有原子数目最多的是( )A、钠 B、镁 C、铝 D、铁12. 维生素C(C6H8O6)能增强人体对疾病的抵抗力。下列说法正确的是( )A、维生素C的相对分子质量为178 B、维生素C中碳、氢、氧三种元素的质量比为3:4:3 C、维生素C中氢元素的质量分数约为4.5% D、维生素C由6个碳原子、8个氢原子、6个氧原子构成13. 如图是活性炭净水器示意图,利用该净水器能达到的目的是( )
A、分子间隔变大 B、分子体积变大 C、分子质量变大 D、分子个数变多11. 相同质量的钠、镁、铝、铁中,含有原子数目最多的是( )A、钠 B、镁 C、铝 D、铁12. 维生素C(C6H8O6)能增强人体对疾病的抵抗力。下列说法正确的是( )A、维生素C的相对分子质量为178 B、维生素C中碳、氢、氧三种元素的质量比为3:4:3 C、维生素C中氢元素的质量分数约为4.5% D、维生素C由6个碳原子、8个氢原子、6个氧原子构成13. 如图是活性炭净水器示意图,利用该净水器能达到的目的是( )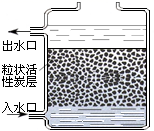 A、软化硬水 B、淡化海水 C、除去水中臭味 D、杀灭水中病毒14. M在N中充分燃烧,发生的反应为M+2N Q+2R。M、N、Q、R均是由分子构成的物质,表中列出了N、Q、R的分子示意图。下列说法错误的是( )
A、软化硬水 B、淡化海水 C、除去水中臭味 D、杀灭水中病毒14. M在N中充分燃烧,发生的反应为M+2N Q+2R。M、N、Q、R均是由分子构成的物质,表中列出了N、Q、R的分子示意图。下列说法错误的是( )物质
N
Q
R

分子示意图


 A、反应前后分子总数不变 B、反应前后原子总数不变 C、消耗的M和N的质量比是1:4 D、生成的Q和R的质量比是22:915. 高锰酸钾是一种重要的化工产品,某种生产高锰酸钾的工业流程如图所示。下列说法错误的是( )
A、反应前后分子总数不变 B、反应前后原子总数不变 C、消耗的M和N的质量比是1:4 D、生成的Q和R的质量比是22:915. 高锰酸钾是一种重要的化工产品,某种生产高锰酸钾的工业流程如图所示。下列说法错误的是( ) A、步骤Ⅰ中发生了物理变化 B、步骤Ⅱ中氮气是生成物之一 C、步骤Ⅲ中水是反应物之一 D、上述流程中KOH可以循环利用
A、步骤Ⅰ中发生了物理变化 B、步骤Ⅱ中氮气是生成物之一 C、步骤Ⅲ中水是反应物之一 D、上述流程中KOH可以循环利用二、综合题
-
16. 实验室里,常采用加热高锰酸钾、分解过氧化氢或加热氯酸钾的方法制取氧气。(1)、写出实验室制取氧气的化学方程式:
①加热高锰酸钾。
②分解过氧化氢。
③加热氯酸钾。
(2)、根据如图所示装置图,回答有关问题:
①写出装置图中标号仪器的名称:a。
②用A作为制取氧气的发生装置,试管口放一团棉花的作用是。
③用过氧化氢溶液制取氧气,选择的发生装置和收集装置为(填字母)。
(3)、用4.9g氯酸钾制取氧气,理论上可制得氧气的质量为。17. 锂元素在元素周期表中的某些信息如图甲所示,锂原子与另外三种粒子的结构示意图如图乙所示。 (1)、锂元素的相对原子质量是 , X= , 锂离子的符号为。(2)、在元素周期表中,锂元素位于第周期。(3)、锂原子与图乙中(填“A”“B”或“C”)粒子的化学性质相似。(4)、图甲和图乙中,共涉及种元素。18. 水是地球上最普通、最常见的物质之一。(1)、明矾可用于净水,是因为明矾溶于水生成的胶状物可以悬浮于水中的杂质,使之从水中沉降出来。(2)、通常状况下水是色液体。请按如图1所示要求填空:①②③④
(1)、锂元素的相对原子质量是 , X= , 锂离子的符号为。(2)、在元素周期表中,锂元素位于第周期。(3)、锂原子与图乙中(填“A”“B”或“C”)粒子的化学性质相似。(4)、图甲和图乙中,共涉及种元素。18. 水是地球上最普通、最常见的物质之一。(1)、明矾可用于净水,是因为明矾溶于水生成的胶状物可以悬浮于水中的杂质,使之从水中沉降出来。(2)、通常状况下水是色液体。请按如图1所示要求填空:①②③④ (3)、氢气在空气里燃烧实验和电解水实验如图2所示。
(3)、氢气在空气里燃烧实验和电解水实验如图2所示。
①图示实验发生的反应中,属于分解反应的化学方程式为。
②下列有关图示实验的说法正确的是(填字母)。
A 两个实验均可证明水的组成
B 点燃氢气前一定要检验其纯度
C 冷而干燥的烧杯内壁出现无色液滴
D 管a内的气体能被燃着的木条点燃
19. 定量研究对于化学的发展有重大作用。(1)、大量实验证明,的质量总和,等于反应后生成的各物质的质量总和。这个规律叫做质量守恒定律。(2)、化学反应前后肯定没有变化的是(填字母)。A 原子种类
B 原子数目
C 分子种类
D 分子数目
E 元素种类
F 元素质量
G 物质种类
H 物质的总质量
(3)、镁条燃烧的实验如图所示。取一根用砂纸打磨干净的长镁条和一个石棉网,将它们一起放在托盘天平上称量,质量为m1。在石棉网上方将镁条点燃,将镁条燃烧后的产物与石棉网一起放在托盘天平上称量,质量为m2。①镁条燃烧的化学方程式为 , 现象为。
②理论上m1应小于m2 , 请运用质量守恒定律进行解释:。
③若实际称得的m1大于m2 , 可能的原因是。
 20. 图中A~I是初中化学常用的物质。其中A、B、D、F、I为单质,其余均为氧化物;C是人体内含量最多的物质,H中氧元素的质量分数为40%;通常状况下,A、G、F三种物质的状态不同,D为淡黄色固体。图中“﹣”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。
20. 图中A~I是初中化学常用的物质。其中A、B、D、F、I为单质,其余均为氧化物;C是人体内含量最多的物质,H中氧元素的质量分数为40%;通常状况下,A、G、F三种物质的状态不同,D为淡黄色固体。图中“﹣”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。 (1)、写出化学式:C , H。(2)、写出化学方程式:D→E , G→F。(3)、A在反应中提供氧,它具有性。21. 空气中氧气含量测定的再认识。(1)、(经典赏析)教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。该实验中选择使用汞的优点(填字母)。
(1)、写出化学式:C , H。(2)、写出化学方程式:D→E , G→F。(3)、A在反应中提供氧,它具有性。21. 空气中氧气含量测定的再认识。(1)、(经典赏析)教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。该实验中选择使用汞的优点(填字母)。A 汞为液态,在汞槽中起到液封作用
B 汞在加热的条件下,只与氧气反应
C 汞能将密闭装置内空气中的氧气几乎耗尽
D 生成的氧化汞浮在汞的表面,易与汞分离
(2)、(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气含量(实验装置如图2),该实验中红磷过量。写出红磷燃烧的化学方程式:。
 (3)、填写实验报告:
(3)、填写实验报告:实验步骤
实验现象
实验结论
步骤①:在集气瓶内加入少量水,并将水上方空间分成5等份。用弹簧夹夹紧胶皮管。点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧,观察红磷燃烧的现象。
步骤②: , 打开弹簧夹,观察实验现象及水面的变化情况。
烧杯内的水进入集气瓶,最终集气瓶内水平面大约上升至刻度处。
(4)、(拓展探究)某学习小组同学利用传感器监测图2实验过程中集气瓶内压强的变化,实验结果如图3所示,集气瓶内压强先增大,后逐渐减小,最后又迅速增大。
①图中A点压强略微大于大气压强的主要原因是。
②图中B点压强明显小于大气压强的主要原因是。
③图中C点压强几乎等于大气压强的主要原因是。