四川省成都市2021年高考理综-化学一模试卷
试卷更新日期:2021-01-13 类型:高考模拟
一、选择题:
-
1. 《天工开物·火药》中记载“凡火药,以硝石硫磺为主,草木灰为辅. 硝性至阴,硫性至阳,阴阳两物相遇于无隙可容之中,其出也?”(已知火药反应为:2KNO3+S +3C=K2S+N2↑+3CO2↑). 下列认识或相关理解错误的是( )A、硫磺不溶于水 B、“草木灰为辅”指草木灰中含有的炭参与反应 C、硝石在反应中作还原剂 D、“其出也”含义之一指该反应放出气体2. 有机物 N 具有抗肿瘤、镇痛等生物活性. N 可由 M 合成:下列相关说法正确的是( )
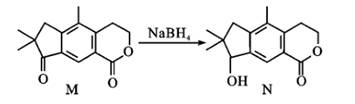 A、M 中所有碳原子可能共面 B、N 可以与钠反应生成 H2 C、M 生成 N 的反应为取代反应 D、M、N 的一氯代物数目相同3. 设 NA为阿伏加德罗常数的值. 下列说法正确的是( )A、标准状况下,11.2L的 CH4和C2H4的混合气体含 C-H 数目为2NA B、100mL0.1mol/L 酸性 KMnO4溶液与足量草酸反应转移电子数为0.03N A C、含 NaClO7.45g的某新冠消毒片溶于足量水中,所得溶液含阴阳离子总数为0.2NA D、0.5molCO2溶于水,溶液中的 H2CO3、HCO3- 、CO23- 微粒数总和为0.5NA4. X、Y、Z、W 为原子序数依次增大的短周期主族元素. 它们能形成离子化合物 A([YX4]+[ZW4]-).Y 元素的最高正价和最低负价代数和为2,Z单质在常温下能被浓硫酸钝化. 下列说法错误的是( )A、W 元素位于第三周期ⅦA 族 B、氧化物的水化物的酸性:W<Y C、原子半径:Y<Z D、A 能与强碱反应生成有刺激性气味的气体5. 实验室探究二氧化碳与锌粉反应是否有一氧化碳生成. 利用下列装置进行相关实验(已知题设下 CO、H2与银氨溶液反应都生成黑色沉淀). 其中方案设计不合理的是( )A、制 CO2
A、M 中所有碳原子可能共面 B、N 可以与钠反应生成 H2 C、M 生成 N 的反应为取代反应 D、M、N 的一氯代物数目相同3. 设 NA为阿伏加德罗常数的值. 下列说法正确的是( )A、标准状况下,11.2L的 CH4和C2H4的混合气体含 C-H 数目为2NA B、100mL0.1mol/L 酸性 KMnO4溶液与足量草酸反应转移电子数为0.03N A C、含 NaClO7.45g的某新冠消毒片溶于足量水中,所得溶液含阴阳离子总数为0.2NA D、0.5molCO2溶于水,溶液中的 H2CO3、HCO3- 、CO23- 微粒数总和为0.5NA4. X、Y、Z、W 为原子序数依次增大的短周期主族元素. 它们能形成离子化合物 A([YX4]+[ZW4]-).Y 元素的最高正价和最低负价代数和为2,Z单质在常温下能被浓硫酸钝化. 下列说法错误的是( )A、W 元素位于第三周期ⅦA 族 B、氧化物的水化物的酸性:W<Y C、原子半径:Y<Z D、A 能与强碱反应生成有刺激性气味的气体5. 实验室探究二氧化碳与锌粉反应是否有一氧化碳生成. 利用下列装置进行相关实验(已知题设下 CO、H2与银氨溶液反应都生成黑色沉淀). 其中方案设计不合理的是( )A、制 CO2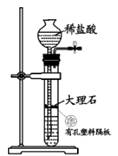 B、除杂、干燥
B、除杂、干燥 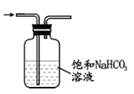 C、CO2与锌粉反应
C、CO2与锌粉反应  D、检查 CO
D、检查 CO 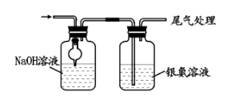 6. 对下列实验,一定能正确描述其反应过程的离子方程式是( )A、向稀硝酸中加入过量铁粉:Fe+4H+NO3-=Fe3++NO↑ +2H2O B、向饱和 Na2CO3溶液中滴入几滴稀 AlCl3溶液:2Al3++3CO23-+3H2O=2Al(OH)3↓ +3CO2↑ C、乙酸乙酯与稀 NaOH 溶液共热:CH3COOC2H5+OH- CH3COO-+C2H5OH D、向长期露置于空气的酸性 KI溶液先后滴入几滴 FeCl3溶液和淀粉溶液,立即出现蓝色2Fe3++2I- 2Fe2+ +I27. 聚乙烯具有广泛用途,可由乙烯为基本原料制备. 科学家构想用太阳能电池作电源电解 CH4和 CO2制得乙烯,原理如图. 下列说法错误的是( )
6. 对下列实验,一定能正确描述其反应过程的离子方程式是( )A、向稀硝酸中加入过量铁粉:Fe+4H+NO3-=Fe3++NO↑ +2H2O B、向饱和 Na2CO3溶液中滴入几滴稀 AlCl3溶液:2Al3++3CO23-+3H2O=2Al(OH)3↓ +3CO2↑ C、乙酸乙酯与稀 NaOH 溶液共热:CH3COOC2H5+OH- CH3COO-+C2H5OH D、向长期露置于空气的酸性 KI溶液先后滴入几滴 FeCl3溶液和淀粉溶液,立即出现蓝色2Fe3++2I- 2Fe2+ +I27. 聚乙烯具有广泛用途,可由乙烯为基本原料制备. 科学家构想用太阳能电池作电源电解 CH4和 CO2制得乙烯,原理如图. 下列说法错误的是( )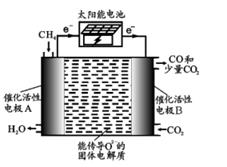 A、该装置实现了光能→电能→化学能的转化 B、电极 A 的反应为:2CH4-4e- +2O2-=C2H4+2H2O C、催化活性电极 B可防止产生炭堵塞电极 D、固体电解质将 A 极产生的 O2- 传导到 B极
A、该装置实现了光能→电能→化学能的转化 B、电极 A 的反应为:2CH4-4e- +2O2-=C2H4+2H2O C、催化活性电极 B可防止产生炭堵塞电极 D、固体电解质将 A 极产生的 O2- 传导到 B极二、非选择题:
-
8. 焦亚硫酸钠(Na2S2O5)具有强还原性,在医药、橡胶、印染、食品方面应用广泛. 某化学小组拟用下列装置制备焦亚硫酸钠.
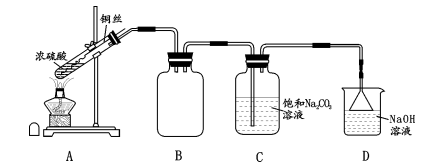
实验步骤:
①按图连接装置,检查装置气密性;
②装入药品,加热 A中试管,C中反应至pH=4.1停止加热,将 A中铜丝外移脱离浓硫酸;
③将 C中液体转移至蒸发装置中,加热,结晶脱水、过滤、洗涤、干燥.
试回答下列问题:
(1)、A 试管中发生反应的化学方程式为 ;B装置的作用是.(2)、C中反应至pH=4.1,C中溶液主要溶质为(填化学式).(3)、将步骤③C中液体加热至过饱和结晶脱水生成焦亚硫酸钠的化学方程式为 ;若温度稍过高,可能还会生成 ;为了制得较纯净焦亚硫酸钠,步骤 ③ 中应注意 、.(4)、Na2S2O5可用作食品抗氧剂. 小组通过下述方法检测某饮料中残留的 Na2S2O5:① 取100.00mL饮料于锥形瓶中,加入0.0100mol/L的I2溶液V1 mL,塞紧瓶塞充分反应.
② 打开瓶塞,将锥形瓶内液体调至接近中性,滴加4~5滴淀粉溶液变蓝. 用0.100mol/L的 Na2S2O3 溶 液 滴 定,滴 定 至 终 点 时,消 耗 Na2S2O3溶 液V2 mL,饮 料 中 残 留 的 Na2S2O5为 mg/L. 若滴定前溶液pH 调至大于10,则残留的 Na2S2O5测定值(填“偏高”、“偏低”或“无影响”).
(已知:S2O52- +2I2+3H2O=2SO42- +4I- +6H+ 2S2O32- +I2=S4O62- +2I- )
9. 纳米氧化镁是在磁性、催化方面有许多特异功能的新材料,具有重要价值. 工业以菱镁矿(主要成分为 MgCO3 , 少量 FeCO3和 SiO2杂质)为原料制备纳米氧化镁工艺流程如下:试回答下列问题:
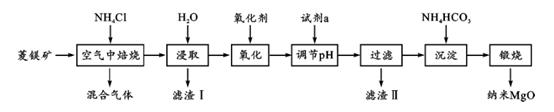 (1)、“焙烧”时生成的主要气体有 ;滤渣Ⅰ的主要成分为(2)、氧化剂常用空气或 H2O2而不选用酸性 KMnO4 , 解释其原因 .
(1)、“焙烧”时生成的主要气体有 ;滤渣Ⅰ的主要成分为(2)、氧化剂常用空气或 H2O2而不选用酸性 KMnO4 , 解释其原因 .已知在该条件下金属离子开始沉淀和完全沉淀的pH 如下:
金属离子
Fe2+
Fe3+
Mg2+
开始沉淀pH
6.3
1.5
8.9
完全沉淀pH
8.1
2.8
10.9
上述流程中“氧化”是否可省掉及理由是 .
(3)、试剂a可能是 .(4)、资料显示锻烧 MgCO3比锻烧 Mg(OH)2更容易生成 MgO 纳米材料. “沉淀”时若将NH4HCO3更换成 Na2CO3 , 则产生的后果是 .(5)、该流程中可以循环利用的物质是.10. 生产生活中氨及铵盐有重要用途,而汽车尾气中含 NO、NO2则应降低其排放.(1)、在20℃时,已知:① N2(g) +O2(g)=2NO(g) ,正、逆反应活化能分别为akJ/mol、bkJ/mol;② 4NH3(g) +5O2(g)=4NO(g)+6H2O(l),正、逆反应活化能分别为ckJ/mol、dkJ/mol;则4NH3(g) +6NO(g)=5N2(g)+6H2O(l)的 ΔH 为.
(2)、10.0L的密闭容器中,按物质的量比1∶3投入氮气和氢气,发生反应N2(g) +3H2(g) 2NH3(g) ΔH<0
用传感器测得温度为T1、T2时容器中 (N2)随时间变化如下表:

0
5min
10min
15min
20min
T1
0.1mol
0.08mol
0.062mol
0.05mol
0.05mol
T2
0.1mol
0.07mol
-----
xmol
0.06mol
①T2时,0~5min内 NH3平均速率为v(NH3)=;
②T1时,该反应平衡常数为 (列出计算式);
③ x 0.06(填“>”、“<”或“=”),原因是.
(3)、汽车排气管装有三元催化剂装置,在催化剂表面通过发生吸附、解吸消除 CO、NO 等污染物. 反应机理如下[Pt(s)表示催化剂,右上角带“·”表示吸附状态]:
Ⅰ NO + Pt(s)=NO*
Ⅱ CO + Pt(s)=CO*
Ⅲ NO*=N* + O*
Ⅳ CO* + O*=CO2+ Pt(s)
Ⅴ N* + N*=N2+ Pt(s)
Ⅵ NO* + N= N2O+ Pt(s)
经测定汽车尾气中反应物及生成物浓度随温度变化关系如图一和图二所示:
图一
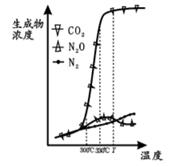 图二
图二 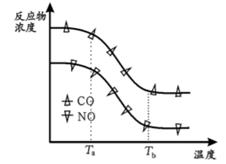
①图一,温度为33℃时发生的主要反应为 (填 “Ⅳ ”、 “Ⅴ ” 或 “Ⅵ ”); 反 应 Ⅵ 为反应(填“放热”或“吸热”).
②图二, 温度从Ta升至Tb的过程中,反应物浓度急剧减小的主要原因是
③气体在固体催化剂表面反应中,吸附和解吸同时影响总反应速率. 温度一定时,反应2NO +2CO N2+2CO2的反应速率随强的变化如图所示. 结合(3)中反应机理,试从吸附和解吸角度解释 bc段化学反应速率下降的原因 .
 11. 铁、钴均为第四周期Ⅷ族元素,它们的单质及化合物具有广泛用途. 回答下列问题:(1)、基态Co2+中成单电子数为;Fe和 Co的第三电离能I3(Fe)I3(Co) (填 “>”、“<”或“=”).(2)、化学上可用 EDTA 测定 Fe2+ 和 Co2+ 的含量. EDTA 的结构简式如图所示:
11. 铁、钴均为第四周期Ⅷ族元素,它们的单质及化合物具有广泛用途. 回答下列问题:(1)、基态Co2+中成单电子数为;Fe和 Co的第三电离能I3(Fe)I3(Co) (填 “>”、“<”或“=”).(2)、化学上可用 EDTA 测定 Fe2+ 和 Co2+ 的含量. EDTA 的结构简式如图所示: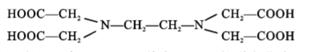
①EDTA 中电负性最大的元素是 , 其中 C原子轨道杂化类型为 ;
②EDTA 存在的化学键有 (填序号).
a. 离子键 b. 共价键 c. 氢键 d.σ键 e.π键 f. 配位键
(3)、将1mol CoCl3·4NH3溶于水中,加入足量 AgNO3溶液生成 1 mol AgCl沉淀. 则CoCl3·4NH3中配离子的化学式为;已知孤电子对与成键电子的排斥作用大于成键电子对与成键电子的排斥作用,试判断 NH3分子与钴离子形成配合物后 H-N-H 键角(填“变大”、“变小”或“不变”).(4)、一种铁氮化合物具有高磁导率,其结构如图所示: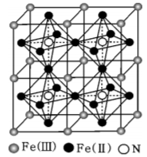
已知晶体的密度为ρg·cm-3 , 阿伏加德罗常数为 NA.
①该结构中单纯分析铁的堆积,其堆积方式为;
②该铁氮化合物的化学式为;
③计算 Fe(Ⅱ)构成正八面体的体积为cm3.
12. 有机化合物 F为一种药物合成中间体. 其合成路线如下: (1)、A 的名称为;反应①的条件.(2)、反应 ② 的化学方程式为.(3)、D的结构简式为.(4)、反应 ④ 分两步进行,第一步中 D与
(1)、A 的名称为;反应①的条件.(2)、反应 ② 的化学方程式为.(3)、D的结构简式为.(4)、反应 ④ 分两步进行,第一步中 D与 发生加成反应的化学方程式为 , 第二步的反应类型为 . (5)、反应 ⑤ 中 E断键的位置为 (填编号).(6)、
发生加成反应的化学方程式为 , 第二步的反应类型为 . (5)、反应 ⑤ 中 E断键的位置为 (填编号).(6)、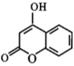 的同分异构体中,满足下列条件 ①除苯环外,没有其它环;②苯环上只有两个取代基;③能与 NaHCO3溶液反应生成气体;④遇 FeCl3溶液显紫色的同分异构体共有种;其中核磁共振氢谱有四组峰,面积比为2∶2∶1∶1的结构简式为
的同分异构体中,满足下列条件 ①除苯环外,没有其它环;②苯环上只有两个取代基;③能与 NaHCO3溶液反应生成气体;④遇 FeCl3溶液显紫色的同分异构体共有种;其中核磁共振氢谱有四组峰,面积比为2∶2∶1∶1的结构简式为